Какие физические свойства характерны для углеводородов
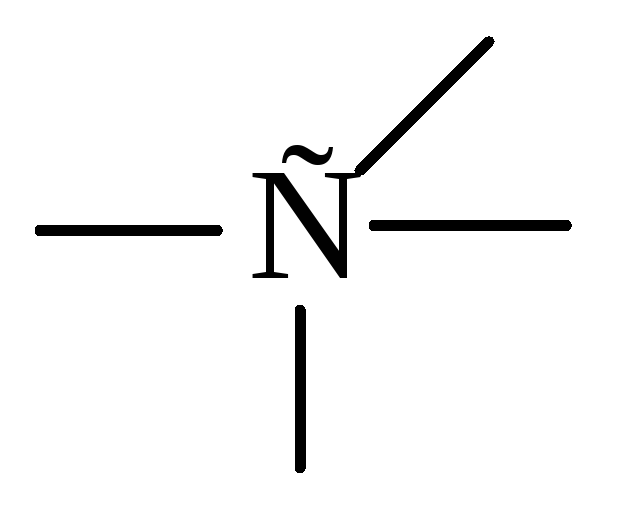
Предельные, углеводороды ряда метана (алканы)
Алканы, или парафины — алифатические
предельные углеводороды, в молекулах которых атомы углерода связаны между собой
простой s-связью.
Оставшиеся валентности углеродного атома, не затраченные на связь с другими
атомами углерода, полностью насыщены водородом. Поэтому предельные углеводороды
содержат в молекуле максимальное число водородных атомов.
Углеводороды ряда алканов имеют общую
формулу CnH2n+2. В таблице представлены некоторые
представители ряда алканов и их некоторые физические свойства.
Формула | Название | Название | Т | Т |
CH4 | метан | метил | -184 | -162 |
C2H6 | этан | этил | -172 | -88 |
C3H8 | пропан | пропил | -190 | -42 |
C4H10 | бутан | бутил | -135 | -0,5 |
C4H10 | изобутан | изобутил | -140 | -10 |
C5H12 | пентан | пентил | -132 | 36 |
C5H12 | изопентан | изопентил | -161 | 28 |
C5H12 | неопентан | неопентил | -20 | 10 |
C6H14 | гексан | гексил | -94 | 69 |
C7H16 | гептан | гептил | -90 | 98 |
C10H22 | декан | децил | -30 | 174 |
C15H32 | пентадекан | 10 | 271 | |
C20H42 | эйкозан | 37 | 348 |
Из таблицы видно, что эти углеводороды
отличаются друг от друга количеством групп — СН2-.Такой ряд сходных
по строению, обладающих близкими химическими свойствами и отличающихся друг от
друга числом данных групп называется гомологическим рядом. А вещества,
составляющие его, называются гомологами.
Тренажёр
№1 — Гомологи и изомеры
Тренажёр
№2. — Гомологический ряд предельных углеводородов
Физические
свойства
Первые четыре
члена гомологического ряда метана — газообразные вещества, начиная с пентана —
жидкости, а углеводороды с числом углеродных атомов 16 и выше — твердые
вещества (при обычной температуре). Алканы — неполярные соединения и трудно
поляризуемые. Они легче воды и в ней практически не растворяются. Не
растворяются также в других растворителях с высокой полярностью. Жидкие алканы
— хорошие растворители для многих органических веществ. Метан и этан, а также
высшие алканы не имеют запаха. Алканы — горючие вещества. Метан горит
бесцветным пламенем.
Получение
алканов
Для получения
алканов используют в основном природные источники.
Газообразные
алканы получают из природного и попутных нефтяных газов, а твердые алканы — из
нефти. Природной смесью твердых высокомолекулярных алканов является горный
воск —природный битум.
1. Из
простых веществ:
nC + 2nН2500 °С, кат → СnН2n+ 2
2. Действие
металлического натрия на галогенопроизводные алканов— реакция А.Вюрца:
2CH3-Cl + 2Na → CH3-CH3
+ 2NaCl
Химические свойства алканов
1. Реакции замещения — Галогенирование (стадийно)
CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl (1 стадия)
;
метан
CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl (2 стадия);
СH2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl (3 стадия);
CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl (4 стадия).
2. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2t→ nCO2 +
(n+1)H2O
Горение метана
Горение пропан-бутановой смеси
3. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-)
связи:
C10H22 → C5H12
+ C5H10
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С (сажа) и Н2:
СH4 1000°С→
C + 2H2
Применение
·
Предельные
углеводороды находят широкое применение в самых разнообразных сферах жизни и
деятельности человека.
·
Использование
в качестве топлива – в котельных установках, бензин, дизельное топливо,
авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
·
Вазелин
используется в медицине, парфюмерии, косметике, высшие алканы входят в состав
смазочных масел, соединения алканов применяются в качестве хладагентов в
домашних холодильниках
·
Смесь
изомерных пентанов и гексанов называется петролейным эфиром и применяется в
качестве растворителя. Циклогексан также широко применяется в качестве
растворителя и для синтеза полимеров.
·
Метан
используется для производства шин и краски
·
Значение
алканов в современном мире огромно. В нефтехимической промышленности предельные
улеводороды являются базой для получения разнообразных органических соединений,
важным сырьем в процессах получения полупродуктов для производства пластмасс,
каучуков, синтетических волокон, моющих средств и многих других веществ. Велико
значение в медицине, парфюмерии и косметике.
Задания для закрепления
№1.
Составьте уравнения реакций горения этана и бутана.
№2.
Составьте
уравнения реакций получения бутана из следующих галогеналканов:
CH3 — Cl (хлорметан) и C2H5 — I (йодэтан).
№3. Осуществите
превращения по схеме, назовите продукты:
C→ CH4 → CH3Cl → C2H6
→ CO2
№4. Реши кроссворд
По горизонтали:
1.
Алкан, имеющий молекулярную формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3. Французский химик, имя которого носит реакция получения углеводородов с
более длинной углеродной цепью взаимодействием галогенопроизводных предельных
углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы
метана.
5. Трихлорметан.
6. Название радикала С2Н5–.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных
условиях.
Если
вы правильно ответили на вопросы, то в выделенном столбце по вертикали получите
одно из названий предельных углеводородов. Назовите это слово?
Химические свойства алканов
1. Реакции замещения —Галогенирование (стадийно)
CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl (1 стадия) ; метан
CH3Cl + Cl2 hν→CH2Cl2 (дихлорметан)+ HCl (2 стадия);
СH2Cl2 + Cl2 hν →CHCl3 (трихлорметан)+ HCl (3 стадия);
CHCl3 + Cl2 hν →CCl4 (хлорметан)+ HCl (4 стадия).
2. Реакции горения(горят светлым не коптящим пламенем)
CnH2n+2 + O2 t→ nCO2+ (n+1)H2O
3. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 → C5H12 + C5H10
б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С (сажа) и Н2:
СH41000°С→ C + 2H2
Физические свойства
Первые четыре члена гомологического ряда метана — газообразные вещества, начиная с пентана — жидкости, а углеводороды с числом углеродных атомов 16 и выше — твердые вещества (при обычной температуре). Алканы — неполярные соединения и трудно поляризуемые. Они легче воды и в ней практически не растворяются. Не растворяются также в других растворителях с высокой полярностью. Жидкие алканы — хорошие растворители для многих органических веществ. Метан и этан, а также высшие алканы не имеют запаха. Алканы — горючие вещества. Метан горит бесцветным пламенем.
Применение предельных углеводородов.
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
·Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
·Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках
·Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
·Метан используется для производства шин и краски
·Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
Какие степени окисления возможны и характерны для железа? Приведите примеры соединений.
Для железа характерны степени окисления— +2 и +3.Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли не существующей в свободном виде кислоты HFeO2):
Fe2O3 + 2NaOH=2NaFeO2 + H2O
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли— ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Известны также степени окисления −2 (тетракарбонилферрат натрия), −1, 0 (пентакарбонил железа), +1, +4, +5.
Агрегатное
состояние.
При
стандартных условиях (Т = 298 К, Р = 1 атм)
в зависимости от строения и молекулярной
массы углеводороды могут быть
газообразными, жидкими или твердыми
веществами. Все углеводороды с длиной
цепи С1
– С4
газообразны, С5
– С16
являются жидкостями. Углеводороды
состава С19
и выше – твердые вещества. Тип углеродной
цепи влияет на температуры кипения
(t0k)
и плавления (t0пл).
Так, нормальные углеводороды в отличие
от разветвленных изомеров имеют более
высокие t0kи
t0пл.
Пример:
СН3-СН2-СН2-СН2-СН3 СН3-СН(СН3)-СН2-СН3
н-пентан
изопентан (2-метилбутан)
t0k
= +360С,t0пл
= -1300Сt0k
= +280С,t0пл
= -1600С
Между
молекулами углеводородов в твердом и
жидком состоянии действуют силы
Ван-дер-Ваальса. Между ароматическими
молекулами возникают силы
—
— электронного взаимодействия. Таким
образом, силы сцепления между молекулами
больше у нормальных углеродных цепей
в жидких углеводородах, и отрыв молекулы
от поверхности жидкости сложнее у н –
цепей, чем у изомерных разветвленных.
В твердых углеводородах фазовый переход
твердое тело
жидкость определяется плотностью
упаковки молекул. Эта упаковка компактнее
у неразветвленных углеводородов. Поэтому
н – углеводороды плавятся при более
высокой температуре, чем разветвленные.
Рыхлость упаковки молекул разветвленных
углеводородов в твердой фазе обусловливает
более слабые силы межмолекулярного
взаимодействия, более низкие энергии
кристаллической решетки.
Введение
одной двойной связи несколько понижает
t0k
(на 5-70)
по сравнению с алканами. Зависимость
t0пл
более сложна.
Сопряженные
алкадиены по t0k
напоминают алканы, т. е. сопряжение не
влияет на температуру кипения. Так, даже
ароматическое сопряжение в бензоле
(t0k
= +800С)
не изменяет t0k
(t0k
циклогексана +810С).
С увеличением числа
— связей и особенно в случае их сопряжения
температуры плавления углеводородов
заметно увеличиваются.
Пример:
Н2С=СН-СН2-СН3
Н2С=СН-СН=СН2
НС
С-С
СН
1-бутен
1,3-бутадиен 1,3-бутадиин
t0пл
= -1850С
t0пл
= -1090С
t0пл
= -360С
Арены
имеют в зависимости от типа более сложные
зависимости t0k
и t0пл.
Среди дизамещенных бензола пара –
изомеры всегда имеют более высокие t0пл
(легче замерзают). Введение алкильной
группы в бензол значительно повышает
t0k
(понижает летучесть) и сильно понижает
t0пл.
Цвет,
запах, действие на кожный покров.
Почти
все углеводороды бесцветны за исключением
длинноцепочечных сопряженных полиенов.
Пример:
Н2С=СН-(СН=СН-СН=СН)n-СН=СН2,
при n
= 2 и более появляется окраска (ликопин
или каротин томатов). Одноядерные
ароматические углеводороды бесцветные
соединения.
Запах
органического соединения определяется
его летучестью и характером взаимодействия
с рецепторами органов обоняния.
Газообразные углеводороды (метан, этан,
пропан, бутан) не имеют запаха. Все
газообразные непредельные углеводороды,
начиная от очень слабо пахнущего этилена,
имеют запах, усиливающийся с увеличением
количества
— связей и с их сопряжением. Ацетилен
имеет слабый эфирный запах. Все жидкие
углеводороды имеют запах керосина или
бензина. Твердые углеводороды не пахнут
при обычной температуре, если они не
летучи.
Жидкие
углеводороды раздражающим образом
действуют на кожу.
Плотность,
структурированность жидкого состояния.
Большинство
углеводородов имеют плотность (объемную
массу) меньше 1. Плотность углеводородов
возрастает по мере увеличения молекулярной
массы. Так, в ряду алканов от С1
до С30
плотность возрастает от 0,415 до 0,810, в
ряду алкенов от С3
до С6
от 0,610 до 0,674, в ряду алкинов от С3
до С10
от 0,690 до 0,766. Это обусловлено возрастанием
сил межмолекулярного взаимодействия
за счет появления
— связей.
В
результате
—
-межмолекулярного взаимодействия арены
заметно структурированы, в отличие от
алканов, алкенов и алкинов. Поэтому их
плотность значительно выше, чем у других
углеводородов (для бензола d420
= 0,879) и мало зависит от алкилирования.
Примечание:
обозначениеd4t
означает,
что плотность жидкости измерена при
температуре относительно плотности
воды при 40С.
Растворимость
в воде и неводных растворителях.
При
растворении углеводородов в растворителях
определяющей является сольватация их
молекул, т. к. структурированность жидких
и твердых углеводородов невелика. Под
сольватацией следует понимать всю сумму
энергетических и структурных изменений,
происходящих в системе в процессе
перехода газообразных молекул, ионов,
радикалов или атомов в жидкую фазу
растворителя с образованием однородного
раствора, имеющего определенный
химический состав и структуру. Сольватация
малополярных органических молекул
осуществляется благодаря диполь –
дипольным и дисперсионным взаимодействиям.
Углеводороды хорошо сольватируются
неполярными жидкостями, их
галогенопроизводными, но плохо
сольватируются полярными жидкостями
(водой, спиртами, карбоновыми кислотами).
Чем выше полярность растворителя, тем
ниже растворимость углеводородов.
Поэтому все углеводороды неограниченно
растворяются друг в друге и в
галогенопроизводных (дихлорэтане,
хлороформе, четыреххлористом углероде,
хлористом метилене и т. д. В то же время
они слабо растворяются в спиртах,
кетонах, сложных эфирах и практически
не растворяются в воде.
Горючесть,
взрывоопасность, ядовитость.
Большинство
углеводородов ядовито при хроническом
вдыхании их паров. Особенно опасен
бензол при длительной работе с ним, а
также конденсированные арены с числом
бензольных колец более 4. Последние
способствуют развитию раковых заболеваний
(канцерогенные вещества), поэтому
попадание их в атмосферу и водоемы
недопустимо
Все
углеводороды горючи. При нагревании до
400-6000С без кислорода происходит
обугливание, с кислородом – горение.
Физико
– химические свойства и показатели
пожарной опасности связаны между собой.
Так, низкая температура кипения вещества
указывает на низкую температуру вспышки
данного вещества, а высокая химическая
активность, особенно по отношению к
окислителям, — на низкую температуру
воспламенения.
Так,
в ряду алканов с увеличением длины цепи
повышается температура кипения, а
следовательно, и температура вспышки.
Повышается энтальпия сгорания, и
понижается температура самовоспламенения.
При
сгорании природного газа достигаются
температуры до 10000С
и выше, а сжигание ацетилена в смеси с
кислородом позволяет получать пламя с
температурой до 28000С.
Это используется для резки и сварки
металлов.
Представляет
практический интерес расчет стандартных
теплот сгорания углеводородов. Рассмотрим
этот вопрос на примере алканов.
В
общей формуле уравнение реакции горения
алканов может быть записано следующим
образом:
CnH2n+2
+ (3n+1)/2 O2
= nCO2
+ (n+1)H2O
Cтандартная
теплота сгорания сН298
может быть рассчитана по разности
стандартных теплот образования продуктов
реакции и реагентов:
сН298
= обр
Н298
(продукты) —
обр
Н298
(реагенты).
Для
расчета могут быть использованы величины
обр
Н298,
приведенные, например, в “Справочнике
химика”, 1966 г., Т. 1, стр. 774 – 837, 854 – 875.
Ниже приводятся теплоты образования
из С(тв), О2(газ),
Н2(газ)
газообразного СО2,
жидкой воды (в кДж/моль).
СО2
(газ) обр
Н298
= -393,3,
Н2О
(ж) обр
Н298
= -285,8.
Теплоты
образования органических соединений
с хорошим приближением можно рассчитывать,
пользуясь так называемыми инкрементами.
При этом исходят из предположения о
том, что каждая структурная единица
вносит в теплоту образования всегда
один и тот же вклад, независимо от того,
в каком соединении эта единица находится
(принцип аддитивности). Ниже приведена
таблица 2 структурных инкрементов,
достаточных для расчета теплот образования
алканов.
Таблица
2
Величины
структурных инкрементов
Элемент | Структурный кДж/моль |
СН3 | -42,34 |
-СН2- | -20,63 |
| -4,56 |
| 3,35 |
Расчет
стандартной теплоты сгорания пропана.
СН3
– СН2
– СН3
+ 5О2
3СО2
+ 4Н2О
Сумма
теплот образования продуктов равна:
3(-393,3)
+ 4(-285,8)
= -2323,1 кДж/моль
Сумма
теплот образования реагентов:
(-42,34)
2
+ (-20,63) = -105,31 кДж/моль
(Теплота
образования О2(газ)
из О2(газ)
естественно равна нулю.
Разность
дает стандартную теплоту сгорания
пропана:
сН298
= -2323,1-(-105,3) = -2217,8 кДж/моль
При
добыче угля в шахтах часто выделяется
метан,
образуя с воздухом взрывоопасные смеси.
При взрыве метано-воздушных смесей
развивается давление до 706 кПа. Поэтому
там, где может выделяться природный
газ, очень важно следить за составом
воздуха. Для предупреждения взрыва при
аварийном выделении метана и для тушения
факела в закрытых объемах используют
СО2
или азот. Минимальная концентрация
диоксида углерода как огнетушащего
средства равна 26% (об.), азота 39% (об.). С
хлором метан образует смесь, взрывающуюся
при действии на нее солнечного света
или другого сильного источника света.
Взрыв смеси метана с хлором может
произойти и при ее нагревании до 1500С.
Поэтому недопустимо совместное хранение
баллонов с хлором и метаном.
Представитель
алкенов – этилен
способен
самовозгораться в атмосфере хлора. Эта
реакция протекает со взрывом, особенно
если на смесь попадает солнечный свет.
Поэтому совместное хранение баллонов
с хлором и этиленом недопустимо. В
отличие от метана этилен горит сильно
светящимся пламенем, что обусловлено
повышенным содержанием углерода. Смесь
этилена с воздухом при поджигании
взрывается с большой силой. Давление
при этом достигает 764 кПа. Минимальная
концентрация диоксида углерода как
огнетушащего средства в этом случае
составляет 42% (об.), а азота 52% (об.). Эти
концентрации намного выше, чем в случае
метана, что объясняется более широким
диапазоном пределов воспламенения
этилена.
Ацетилен
под давлением неустойчив. При давлении
более 196 кПа ацетилен способен разлагаться
со взрывом до углерода и водорода.
Температура взрыва 30000С,
давление увеличивается приблизительно
в 11 раз. Поэтому ацетилен нельзя хранить
в сжатом состоянии, подобно другим
газам, в стальных баллонах обычного
типа. Для его хранения и перевозки
применяют баллоны, наполненные активным
углем, пропитанным ацетоном, в котором
и растворяют ацетилен под давлением.
При таком способе хранения ацетилен не
взрывается даже при давлении 2940 кПа.
Ацетилен с воздухом образует взрывчатые
смеси. Пределы воспламенения: НПВ – 2%
, ВПВ – 81%. Температура самовоспламенения
3350С.
Ацетилено-воздушные смеси взрываются
с большой силой. Давление взрыва достигает
931 кПа. Для предупреждения взрыва при
аварийном выделении ацетилена и для
тушения факела в закрытых помещениях
требуется СО2
57% (об.), а азота 70% (об.).
Нефть
– источник углеводородов, легко
воспламеняющаяся жидкость. Температура
вспышки ее лежит в пределах от -340С
до +340С.
Нефть имеет сравнительно низкую
температуру самовоспламенения, лежащую
в пределах от 260 до 375 К. Кроме того она
имеет высокую теплоту сгорания (выше
42000 кДж/кг). При перегонке нефти получают
следующие фракции:
Газовая
фракция содержит алканы С1
– С4.
Природный газ – это преимущественно
метан (
98%), баллонный газ – это в основном пропан
и бутан.
Бензиновая
фракция (t0k
= 40 – 1800С)
содержит углеводороды С5
– С12,
всего до 100 и более индивидуальных
соединений, в том числе алканы, циклоалканы,
алкилбензолы.
Керосиновая
фракция (t0k
= 180 – 3000С)
содержит в основном углеводороды С9
– С16.
Это топливо для реактивных двигателе
и сырье для крекинга.
Соляровый
дистиллят (t0k
= 300 – 4000С)
состоит примущественно из углеводородов
С15
– С25.
Это сырье для получения дизельного
топлива.
Мазут
(t0k
=
3000С
в вакууме) имеет приблизительный состав
С20
– С30.
Используется как топливо для сжигания
в топках котлов. Фракционной отгонкой
под вакуумом получают смазочные масла,
вазелин, парафин
Ароматический
углеводород бензол
– легковоспламеняющаяся жидкость,
горит сильно коптящим пламенем. При
взрыве паровоздушных смесей развивается
давление до 784 кПа. Ароматические
углеводороды тушат тонкораспыленной
водой и пеной.
50
