Какие частицы могут проявлять только окислительные свойства
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня — особенный день. «И что же в нем такого необычного?» — спросите вы. Отвечаю. Я, наконец-то, добралась до моего самого любимого царства-королевства, до моих конфет и пирожных, малинок и клубничек! Окислительно-восстановительные реакции! Вы даже не представляете, насколько это интересно!
Мои ученики в процессе подготовки к экзамену по химии, проходят несколько стадий вызревания. Первое серьезное испытание на прочность — газы! Это из серии «гестапо отдыхает». Решив огромное количество газовых задач, по сравнению с которыми 28-е задачи ЕГЭ — детский лепет, народ полностью структурирует свой мозг и настраивает мышление на профессиональное восприятие химии по-взрослому.
Вторая ступень химической зрелости и мудрости — окислительно-восстановительные реакции. Они приучают к усидчивости и внимательности. Набравшись опыта в написании ОВР, ребята начинают чувствовать себя ломоносовыми, клапейронами и менделеевыми в одном флаконе. За спиной вырастают крылья и… понеслось! Дальнейшее изучение химии проходит на едином дыхании, профессиональный рост — в геометрической прогрессии. На этой стадии мои ученики уже могут заткнуть за пояс каждого второго школьного преподавателя химии!
Понимая всю серьезность материала статьи, я отключила мобильную связь с внешним миром — с Карлсоном, Алисой (которая из страны Чудес), Сири, Фрекен Бок (тем более, что она работает химичкой в школе, где учится Малыш) и всеми остальными озорниками и хулиганами. Оставила только астральную связь для служебного пользования. Возможно, музы на чаек залетят или еще кто-нибудь забредет. А мы с вами займемся самым интересным делом — будем раскладывать по полочкам все накопленные мною знания по теории и практике окислительно-восстановительных реакций. Долго будем этим заниматься. Пока не надоест. Итак, поехали!
Окислительно-восстановительные реакции (ОВР) — химические реакции, в результате которых происходит изменение степеней окисления элементов.
ОВР протекают с участием двух участников — окислителя и восстановителя, и состоят из двух противоположных процессов:
1) Окисление — процесс отдачи электронов (восстановитель отдает электроны окислителю, восстановитель окисляется — окислитель восстанавливается).
2) Восстановление — процесс присоединения электронов (окислитель присоединяет электроны от восстановителя, окислитель восстанавливается — восстановитель окисляется).
Кто же вы, господа окислители и восстановители? Как вас узнать среди огромного количества химических веществ? Сегодня разберем самые общие характеристики участников ОВР (окислителей и восстановителей) на отдельных примерах. После изучения технологии написания ОВР (в следующей статье), поработаем с целыми семействами окислителей и восстановителей, с неорганическими и органическими веществами, проводя реакции в разных средах. А пока — читаем внимательно!
Окислитель — атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
Окислительная активность — способность атома отбирать электроны у других атомов.
Окислительно-восстановительный потенциал (редокс-потенциал) — показатель окислительной активности, мера способности атомов химического элемента присоединять электроны (восстанавливаться). Стандартные потенциалы окислительно-восстановительных пар помещены в таблицу.
Чем выше стандартный потенциал окислительно-восстановительной пары, тем выше окислительная активность атомов элемента, тем он — более сильный окислитель
Окислительную активность определяют два фактора:
1) Электроотрицательность. Чем выше электроотрицательность химического элемента, тем выше окислительная активность простого вещества. В Периодической Системе Элементов электроотрицательность растет в сторону правого верхнего угла (слева направо и снизу вверх). Самый сильный окислитель — фтор, на втором месте — кислород.
2) Степень окисления. Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (она равна номеру группы). Почему? Да, потому что у такого атома на внешнем уровне вообще нет валентных электронов. Ни одного. Все валентные электроны он где-то потерял (отдал кому-то) и остался гол, как сокол (в чем мать родила). Больше отдавать нечего, поэтому можно только присоединять.
У вас часто возникает вопрос — почему при дефиците электронов формируется положительная степень окисления или положительный заряд иона (т.е. почему у окислителя валентные электроны в дефиците или отсутствуют, а его заряд +n)? Да, потому что электроны заряжены отрицательно, а протоны (в ядре) — положительно. В электронейтральном атоме протоны и электроны уравновешены (сколько протонов, столько электронов). Если электроны убрать, то проявятся положительные заряды протонов, которые никуда не деваются в химических реакциях (их можно сдвинуть с насиженного места только ядерными реакциями). Теперь понятно? Если все еще «ежик в тумане», читайте эту и следующие статьи. Я буду рассматривать все тяжело понимаемые моменты с разных сторон. В конце концов, все станет на свои места и туман рассеется.
Давайте, придумаем образ окислителя. Кто вы, мистер-окислитель? Это — захватчик, завоеватель, грабитель, который скачет на коне и, угрожая, копьем и ружьем, отбирает электроны у восстановителей (часто, отбирает все, что есть). Окислитель не только безжалостный разбойник, но еще и жадина — очень проблематично вернуть назад электроны, которые забрал окислитель. Как только окислитель ограбит восстановителя (заберет у него электроны) он тут же падает вниз по градационной шкале степеней окисления («падает в глазах окружающих»).
Пример сильного окислителя — перманганат-ион. Его часто используют в различных ОВР. Обратите внимание, в зависимости от среды реакции, перманганат-ион образует различные продукты.
Ребята, не слушайте училок-химичек, которые заставляют запоминать продукты ВСЕХ окислительно-восстановительных реакций. Если вы забыли образующиеся вещества и просите помочь, они орут, обзывая вас неучами и и бездельниками. При этом, сами срочно хватают спасательный учебник по химии и пафосно зачитывают вам и всему классу продукты конкретной реакции. Вы задайте этим глупым училкам вопрос — помнят ли они дни рождения всех своих родственников? Что касается меня, то после 16-ти часов работы (такое тоже бывает), я часто забываю номер своего телефона. Но… ЛЮБУЮ ОВР напишу за пару минут (как говорят, темной ночью под кроватью)! Потому, что знаю особые секреты окислительно-восстановительных реакций, которые, между прочим, собираюсь раскрыть моим ученикам и всем моим читателям.
Постепенно, статья за статьей, мы будем изучать технологию написания окислительно-восстановительных реакций, знакомиться с целыми семействами окислителей и восстановителей, их особенностями, характером поведения в разных средах, предполагаемыми продукты. Лукавить не буду, кое-что нам, все-таки, придется запомнить. Совсем немного. Чуть-чуть. Примерно 15 точек, включающих продукты ОВР и основные рекомендации. И вы напишите ЛЮБУЮ окислительно-восстановительную реакцию! В ЛЮБОЙ среде!
Первое задание: запомните три продукта восстановления перманганат-иона (выделено красным цветом) в зависимости от среды протекания окислительно-восстановительной реакции (кислая, нейтральная или щелочная).
Восстановитель — атом в составе молекулы или иона, который отдает электроны окислителю. Происходит процесс окисления восстановителя (его степень окисления повышается).
Восстановительная активность — способность атома отдавать электроны другим атомам.
Восстановительную активность определяют два фактора:
1) Радиус атома. Чем больше радиус атома химического элемента, тем выше восстановительная активность простого вещества. В Периодической Системе Элементов радиус атома увеличивается в сторону левого нижнего угла (справа налево и сверху вниз).
2) Степень окисления. Чем ниже степень окисления атома в составе молекулы или иона, тем ярче проявляется восстановительная активность.
Только свойства восстановителя проявляют атомы с минимально возможной степенью окисления. Для неметаллов она равна «восемь минус номер группы». Для металлов — ноль. Как только восстановитель отдаст электроны окислителю, он поднимется вверх по градационной шкале степеней окисления («растет в глазах окружающих»).
Посмотрите, как ведет себя сера в роли восстановителя в разных веществах (с разными степенями окисления).
Настало время придумать образ восстановителя. Кто вы, мистер-восстановитель? У меня восстановитель ассоциируется с добрым дедушкой-альтруистом, который одаривает электронами каждого желающего окислителя.
Как же вас различить, господа окислители и восстановители в группе веществ, предложенных для реакций?!
Окислитель можно отыскать по высокой (иногда, максимально высокой) степени окисления, кроме того, мы изучим многие семейные портреты окислителей. Продукты окислителей мы ЗАПОМНИМ (их около 10, не более), кроме того, проведем анализ процесса восстановления окислителя по градационной шкале степеней окисления.
Восстановитель отыщем по низкой (иногда, максимально низкой) степени окисления. Продукт восстановителя будем устанавливать путем анализа с использованием градационных шкал степеней окисления. Хотя… сделаю вам подарок. Читайте мнемоническое стихотворение. Пригодится.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
Репетитор по химии и биологии кбн В.Богунова
Определение
Окислительно -восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления одного или нескольких элементов.
Окислительно-восстановительные реакции играют важную роль в природе и технике. Фотосинтез, дыхание, брожение, накопление энергии в клетках сопровождаются переносом электронов. Разделяя процессы окисления и восстановления, удается превращать энергию химических реакций в электрическую. Этот принцип лежит в основе работы гальванических элементов и аккумуляторов.
К числу ОВР принадлежат все реакции между простыми и сложными веществами, между двумя простыми веществами, а также некоторые случаи взаимодействия сложных веществ:
$overset{0}{Fe} + overset{+2}{Cu}overset{+6}{S} overset{-2}{O_4} = overset{+2}{Fe}overset{+6}{S} overset{-2}{O_4} +overset{0}{Cu}$
$2overset{0}{Mg} + overset{0}{O_2} = 2overset{+2}{Mg}overset{-2}{O}$
$2overset{+1}{K} overset{-1}{I} + 4overset{+1}{H}overset{+5}{N}overset{-2}{O_3} = overset{0}{I_2} + 2overset{+4}{N}overset{-2}{O_2} + 2overset{+1}{K} overset{+5}{N}overset{-2}{ O_3} + 2overset{+1}{H_2}overset{-2}{O}$
При окислительно-восстановительных реакциях происходит переход электронов от одних атомов к другим.
Определение

Атом, отдающий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается) – окислителем.
Часто термины окислитель и восстановитель переносят и на вещества, в состав которых входят соответствующие атомы. В результате реакции окислитель восстанавливается, а восстановитель окисляется.
Определение
Процесс отдачи атомом электронов называется окислением, а процесс принятия атомом электронов — восстановлением.
Запомни! Нельзя путать название процесса передачи электронов с функцией атома, которую он проявляет в этом процессе.
Восстановителем может быть атом элемента, а восстановление — это процесс принятия электронов.

| $underline{O}$кислитель | $underline{textrm{В}}$осстановитель |
|---|---|
| $underline{textrm{В}}$зял электроны | $underline{O}$тдал электроны |
| $underline{textrm{В}}$осстановился | $underline{O}$кислился |
| $S^{+6} + 2bar{e} rightarrow S^{+4}$ | $S^{-2} -2bar{e} rightarrow S^{0}$ |
| степень окисления $downarrow$ | степень окисления $uparrow$ |
| процесс восстановления | процесс окисления |
| Типичные окислители: | Типичные восстановители: |
|
|
Есть ряд мнемонических правил, которые позволяют лучше запомнить разницу между этими понятиями:
По первым буквам слов можно составить следующие сокращения:
ОВВ: окислитель — взял $bar{e}$ — восстановился
ВОО: восстановитель — отдал — окислился
 2. Или использовать словосочетание «окислитель-грабитель».
2. Или использовать словосочетание «окислитель-грабитель».3. Запомнить стихотворение:
Восстановитель — это тот, кто электроны отдает.
Сам отдает грабителю, злодею-окислителю.
Отдает — окисляется, сам восстановителем является.
КЛАССИФИКАЦИЯ ОВР
Определение
Окислительно-восстановительные реакции в которых окислитель и восстановитель входят в состав разных соединений называют межмолекулярными, а ОВР, в которых и окислитель, и восстановитель входят в состав одного и того же соединения — внутримолекулярными.
К числу внутримолекулярных принадлежат реакции термического разложения некоторых веществ, например, сульфата меди(II):
$2CuSO_4 stackrel{700^circ C}{=} 2CuO + 2SO_2 + O_2$
$mathrm{S^{+6} + 2e^– rightarrow S^{+4}}$ |2 2 окислитель, процесс восстановления
$mathrm{2O^{–2} – 4e^– rightarrow O_2^0}$ |4 1 восстановитель, процесс окисления
__________________________________________________________________________________________
$mathrm{2S^{+6} + 2O^{–2} rightarrow 2S^{+4} + O_2^0}$
Внутримолекулярные ОВР, в свою очередь, также делятся на два типа: реакции диспропорционирования и сопропорционирования.
Определение
Внутримолекулярные окислительно-восстановительные реакции, в которых окислителем и восстановителем является один и тот же элемент, который в начале реакции находится в одной степени окисления, называют диспропорционированием.
К числу таких реакций принадлежит, например, разложение пероксида водорода на воду и кислород.
$2H_2overset{-1}{O_2} rightarrow 2H_2overset{-2}{O} + overset{0}{O_2}$.
Определение
Внутримолекулярные окислительно-восстановительные реакции, в результате которых атомы одного и того же элемента, находящиеся в разных степенях окисления, приобретают одну промежуточную, называют сопропорционированием.
Примером служит взаимодействие сернистого газа с сероводородом, приводящее к образованию серы:
$2H_2overset{-2}{S} + overset{+4}{S}O_2 = 3overset{0}{S} + 2H_2O$.
Ключевые слова конспекта: окислители, восстановители, окисление, восстановление.
Окислитель – вещество, атомы, молекулы или ионы которого принимают электроны. Восстановитель – вещество, атомы, молекулы или ионы которого отдают электроны. Окислителем и восстановителем могут также называть элементы, атомы которых отдают или принимают электроны. Если элемент является окислителем – его степень окисления понижается; если элемент является восстановителем – его степень окисления повышается.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Окислители
Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Вг2, I2, O2, О3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причём от фтора к йоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (Н2O или ОН–).
Среди кислородсодержащих кислот и их солей к наиболее важным окислителям относятся концентрированная серная кислота, азотная кислота и нитраты, перманганаты МnO4–, хроматы СrO42– и дихроматы Сr2O72–.
Концентрированная серная кислота проявляет окислительные свойства за счёт серы в высшей степени окисления +6. Продуктами восстановления серы могут быть: SO2 (степень окисления серы +4), сера – простое вещество (степень окисления серы 0), сероводород (степень окисления серы –2).
Азотная кислота проявляет окислительные свойства за счёт азота в высшей степени окисления +5, причём окислительная способность HNO3 усиливается с ростом её концентрации. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы; чем активнее восстановитель и ниже концентрация кислоты, тем глубже происходит восстановление азота.
Кислородсодержащие кислоты галогенов (например, HClO, HClO3, НВrO3) и их соли, действуя в качестве окислителей, обычно восстанавливаются до степени окисления галогена –1 (в случае хлора и брома) и 0 (в случае иода). Например:
5КСlO3 + 6Р = 5КCl + 3Р2O5
Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, расположенными в раду напряжений до водорода):
Zn + H2SO4 (разб.) = ZnSO4 + Н2↑
При взаимодействии с сильными восстановителями в качестве окислителя может проявлять себя и водород, входящий в состав воды:
2Н2O + 2Na = 2NaOH + Н2↑
Н2O + NaH = NaOH + Н2↑
Ионы металлов, находящихся в высшей степени окисления (например, Fe3+, Hg2+, Cu2+), выполняя функцию окислителей, превращаются в ионы с более низкой степенью окисления:
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
Восстановители
Среди простых веществ к типичным восстановителям принадлежат активные металлы (щелочные и щёлочноземельные, алюминий, цинк, железо и др.), а также некоторые неметаллы, такие, как водород, углерод (в виде угля или кокса), фосфор, кремний. При этом в кислой среде металлы окисляются до положительно заряженных ионов.
Углерод чаще всего окисляется до монооксида СО или диоксида СO2; фосфор при действии сильных окислителей окисляется до ортофосфорной кислоты Н3РO4.
В бескислородных кислотах (НCl, НВг, HI, H2S) и их солях восстановителями являются анионы, которые, окисляясь, обычно образуют простые вещества. В ряду галогенид-ионов восстановительные свойства усиливаются от Cl– к I–.
Металлы в промежуточной степени окисления (ионы Sn2+, Fe2+, Cu+, Hg2+ и др.), взаимодействуя с окислителями, способны повышать свою степень окисления:
2FeCl2 + Cl2 = 2FeCl3
10FeSO4 +2KMnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Образец выполнения задания ОГЭ.
Задание. Степень окисления азота в аммиаке и нитрате калия соответственно
1) –2 и +5
2) –3 и +5
3) +3 и +5
4) –4 и +3
Решение. Определим степени окисления элементов в аммиаке и нитрате натрия:
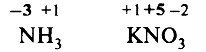
Обратим внимание, что в аммиаке степень окисления азота – отрицательная, так как электроотрицательность азота выше, чем электроотрицательность водорода.
Правильный ответ: 2) –3 и +5.
Конспект урока по химии «Окислители и восстановители».
Темы, связанные с настоящим конспектом:
- Степень окисления химических элементов
- Метод электронного баланса
- Окислительно-восстановительные реакции
