Какие аномальные свойства воды имеют биологическое значение

Введение
Организм человека почти на 70% состоит из воды. Вода — прежде всего растворитель, в среде которого протекают все элементарные акты жизнедеятельности. К тому же вода — продукт и субстрат энергетического метаболизма в живой клетке. Образно говоря, вода — это арена, на которой разыгрывается действие жизни и участник основных биохимических превращений.
Известно что вода присутствует во всех частях нашего организма, хотя например в коре мозга её 85%, в коже 72%, в зубной эмали всего лишь3%. Это свидетельствует о том, что в наиболее интенсивно работающих органах содержится большее число воды.
Некоторая часть воды в организме может более или менее прочно связываться с растворёнными в ней веществами и с поверхностью биополимерных макромолекул с помощью как водородных связей, так и сил ион-дипольного взаимодействия. Это может приводить к заметному изменению конфигурации, эффективных размеров и весов тех или иных частиц, участвующих в реакции, и в некоторых случаях к существенной модификации их свойств. Например, оказывается, что натриевые каналы нервных клеток, имеющие диаметр около 0,5 нм, практически недоступны для прохождения по ним ионов калия, хотя диаметр самого иона K+ равен 0,26 нм. В действительности ион K+ гидратирован и, следовательно, для расчёта его эффективных размеров к диаметру K+ следует прибавить диаметр молекулы воды 0,28 нм. В итоге комплексный ион [K· H2O]+ диаметром почти 0,6 нм сквозь натриевый канал пройти не может, тогда как гидратированный ион [Na· H2O]+ диаметром около 0,47 нм свободно диффундирует через этот канал.
Другим примером изменения размеров биологического субстрата может быть молекула ДНК. В частности известно, что на каждый нуклеотид макромолекулы приходится около 50 молекул воды, связанных с ДНК. В общей сложности водная плёнка ДНК увеличивает эффективный диаметр цилиндрической макромолекулы ДНК с 2 нм в безводном состоянии до 2,9 нм в водном растворе, что чрезвычайно важно, например, при считывании с неё информации.
Строение воды
Вода — уникальное вещество и все её аномальные свойства: высокая температура кипения, значительная растворяющая и диссоциирующая способность, малая теплопроводность, высокая теплота испарения и другие обусловлены строением её молекулы и пространственной структурой.
У отдельно взятой молекулы воды есть качество, которое проявляется только в присутствии других молекул: способность образовывать водородные мостики между атомами кислорода двух оказавшихся рядом молекул, так, что атом водорода располагается на отрезке, соединяющем атомы кислорода. Свойство образовывать такие мостики обусловлено наличием особого межмолекулярного взаимодействия, в котором существенную роль играет атом водорода. Это взаимодействие называется водородной связью.
Каждая из присоединённых к данной молекул воды сама способна к присоединению дальнейших молекул. Этот процесс можно называть «полимеризацией». Если только одна из двух возможных связей участвует в присоединении следующей молекулы, а другая остаётся вакантной, то «полимеризация» приведёт к образованию либо зигзагообразной цепи, либо замкнутого кольца. Наименьшее кольцо, по-видимому, может состоять из четырёх молекул, но величина угла 90° делает водородные связи крайне напряжёнными. Практически ненапряжёнными должны быть пятизвенные кольца (угол 108° ), а шестизвенные (угол 120° ), также как и семизвенные — напряжённые.
Рассмотрение реальных структур гидратов показывает, что, действительно, наиболее устойчиво шестизвенное кольцо, находимое в структурах льдов. Плоские кольца являются привилегией клатратных гидратов, причём во всех известных структурах чаще всего встречаются плоские пятизвенные кольца из молекул воды. Они, как правило, чередуются во всех структурах клатратных гидратов с шестизвенными кольцами, очень редко с четырёхзвенными, а в одном случае — с плоским семизвенным.
В целом структура воды представляется как смесь всевозможных гидратных структур, которые могут в ней образоваться.
В прикладном аспекте это, например, имеет важное значение для понимания действия лекарственных веществ. Как было показано Л. Полингом структурированная клатратная форма воды в межсинаптических образованиях мозга обеспечивает, с одной стороны, передачу импульсов с нейрона на нейрон, а, с другой стороны при попадании в эти участки наркозного вещества такая передача нарушается, то есть наблюдается явление наркоза. Гидратация некоторых структур мозга является одной из основ реализации действия наркотических анальгетиков (морфина).
Биологическое значение воды
Вода как растворитель. Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Результаты многочисленных исследований строения растворов электролитов свидетельствуют, что при гидратации ионов в водных растворах основную роль играет ближняя гидратация — взаимодействие ионов с ближайшими к ним молекулами воды. Большой интерес представляет выяснение индивидуальных характеристик ближней гидратации различных ионов, как степени связывания молекул воды в гидратных оболочках, так и степени искажения в этих оболочках тетраэдрической льдоподобной структуры чистой воды — связи в молекуле изменяются на неполный угол. Величина угла зависит от иона.
Когда вещество растворяется, его молекулы или ионы получают возможность двигаться более свободно и, соответственно, его реакционная способность возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, не смешиваются с водой и потому могут разделять водные растворы на отдельные компартаменты, подобно тому, как их разделяют мембраны. Неполярные части молекул отталкиваются водой и в её присутствии притягиваются друг к другу, как это бывает, например, когда капельки масла сливаются в более крупные капли; иначе говоря, неполярные молекулы гидрофобны. Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности мембран, а также многих белковых молекул, нуклеиновых кислот и других субклеточных структур.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторных системах, в пищеварительном тракте и во флоэме и ксилеме растений.
Большая теплоёмкость. Удельной теплоёмкостью воды называют количество теплоты в джоулях, которое необходимо, чтобы поднять температуру 1 кг воды на 1° C. Вода обладает большой теплоёмкостью (4,184 Дж/г). Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение её температуры. Объясняется такое явление тем, что значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды.
Большая теплоёмкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, для которой характерно довольно значительное постоянство условий.
Большая теплота испарения. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для её перехода в пар, то есть для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии (2494 Дж/г). Это объясняется существованием водородных связей между молекулами воды. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из их окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, при тепловой одышке у млекопитающих или у некоторых рептилий (например, у крокодилов), которые на солнцепёке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев.
Большая теплота плавления. Скрытая теплота плавления есть мера тепловой энергии, необходимой для расплавления твёрдого вещества (льда). Воде для плавления (таяния) необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и поведение воды вблизи точки замерзания. Плотность воды (максимальна при +4° С) от +4 до 0° С понижается, поэтому лёд легче воды и в воде не тонет. Вода — единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твёрдом, так как структура льда более рыхлая, чем структура жидкой воды.
Поскольку лёд плавает в воде, он образуется при замерзании сначала на её поверхности и лишь под конец в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоёмах вообще не могла бы существовать. То обстоятельство, что слои воды, температура которых упала ниже 4° С, поднимаются вверх, обусловливает перемешивание воды в больших водоёмах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоёмы заселяются живыми организмами на большую глубину.
После проведения ряда экспериментов было установлено, что связанная вода при температуре ниже точки замерзания не переходит в кристаллическую решётку льда. Это энергетически невыгодно, так как вода достаточно прочно связана с гидрофильными участками растворённых молекул. Это находит применение в криомедицине.
Большое поверхностное натяжение и когезия. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь её поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды (7,6 · 10-4 Н/м). Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях. Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по её поверхности.
Вода как реагент. Биологическое значение воды определяется и тем, что она представляет собой один из необходимых метаболитов, то есть участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода в процессе фотосинтеза, а также участвует в реакциях гидролиза.
Особенности талой воды
Уже небольшое нагревание (до 50-60° С) приводит к денатурации белков и прекращает функционирование живых систем. Между тем охлаждение до полного замерзания и даже до абсолютного нуля не приводит к денатурации и не нарушает конфигурацию системы биомолекул, так что жизненная функция после оттаивания сохраняется. Это положение очень важно для консервирования органов и тканей предназначенных для пересадки. Как указывалось выше, вода в твёрдом состоянии имеет другую упорядоченность молекул, чем в жидком и после замерзания и оттаивания приобретает несколько иные биологические свойства, что послужило причиной применения талой воды с лечебной целью. После оттаивания вода имеет более упорядоченную структуру, с зародышами клатратов льда что позволяет ей взаимодействовать с биологическими компонентами и растворёнными веществами, например с другой скоростью. При употреблении талой воды в оганизм попадают мелкие центры льдоподобной структуры, которые в дальнейшем могут разрастись и перевести воду во льдоподобное состояние и тем самым произвести оздоравливающее действие.
Информационная роль воды
При взаимодействии молекул воды со структурными компонентами клетки могут образовываться не только вышеописанные пяти-, шести- и т. д. компонентные структуры, но и трёхмерные образования могут образовываться додекаэдральные формы, которые могут обладать способностью к образованию цепочечных структур, связанных общими пятиугольными сторонами. Подобные цепочки могут существовать и в виде спиралей, что делает возможным реализацию механизма протонной проводимости по этому универсальному токопроводу. Следует также учесть данные С. В. Зенина (1997 г.), что молекулы воды в таких образованиях могут взаимодействовать между собой по принципу зарядовой комплементарности, то есть посредством дальнего кулоновского взаимодействия без образования водородных связей между гранями элементов, что позволяет рассматривать структурированное состояние воды в виде исходной информационной матрицы. Такая объёмная структура имеет возможность переориентироваться, в результате чего происходит явление «памяти воды», так как в новом состоянии отражено кодирующее действие введённых веществ или других возмущающих факторов. Известно, что такие структуры существуют непродолжительное время, но в случае нахождения внутри додекаэдра кислорода или радикалов происходит стабилизация таких структур.
В прикладном аспекте возможности «памяти воды» и передачи информации посредством структурированной воды объясняют действие гомеопатических средств и акупунктурных воздействий.
Как уже говорилось, все вещества при растворении в воде образуют гидратные оболочки и поэтому каждой частице растворённого вещества соответствует конкретная структура гидратной оболочки. Встряхивание такого раствора приводит к схлопыванию микропузырьков с диссоциацией молекул воды и образованию протонов, стабилизирующих такую воду, которая приобретает излучательные свойства и свойства памяти, присущие растворённому веществу. При дальнейшем разведении этого раствора и встряхивании образуются всё более длинные цепи — спирали и в 12-сотенном разведении уже нет самого вещества, но сохраняется память о нём. Введение этой воды в организм передаёт эту информацию в структурированные компоненты воды биологических жидкостей, которая передаётся структурным компонентам клеток. Таким образом, гомеопатический препарат действует прежде всего информационно. Добавление спирта в процессе приготовления гомеопатического средства удлиняет устойчивость во времени структурированной воды.
Не исключено, что спиралеобразные цепи структурированной воды являются возможными компонентами переноса информации из биологически активных точек (точек акупунктуры) на структурные компоненты клеток определённых органов.
Список литературы
- Садовничая Л. П. с соавт. Биофизическая химия, К.: Вища школа, 1986. — 271 с.
- Габуда С. П. Связанная вода. Факты и гипотезы, Новосибирск: Наука, 1982. — 159 с.
- Сб. Структура и роль воды в живом организме, Л.: Изд. ЛГУ, 1966. — 208 с.
- Бышевский А. Ш., Терсенов О. А. Биохимия для врача, Екатеринбург: изд. «Уральский рабочий», 1994. — 378 с.
- Грин Н., Стаут У., Тейлор Д. Биология, т. 1.: Пер. с англ. — М.: Мир, 1993. — 368 с.
- Чанг Р. Физическая химия с приложениями к биологическим системам М.: Мир, 1980. — 662 с.
- Зенин С. В. Водная среда как информационная матрица биологических процессов. В кн. Тезисы докладов 1 Международного симпозиума, Пущино, 1997, с. 12-13.
- Смит С. Электромагнитная биоинформация и вода. Вестник биофизической медицины, 1994 №1, с. 3-13.
- Антонченко В. Я., Ильин В. В. Проблемные вопросы физики воды и гомеопатии. Вестник биофизической медицины, 1992 №1, с.11-13.
Люди привыкли к воде и считают ее обычным веществом. Они часто воспринимают ее как нечто само собой разумеющееся до тех пор, пока засуха не начнет угрожать посевам и запасам питьевой воды, или сильное наводнение не создаст угрозу жизни и имуществу. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Один из ранних греческих философов, Фалес Милетский (640-546 гг. до н. э.), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Формы материи
Все вещества существуют в трех различных состояниях, которые зависят от температуры и давления. Твердые тела обладают определенной формой и имеют кристаллическую внутреннюю структуру. По этому определению вещество, подобное стеклу, будет считаться высоковязкой жидкостью, поскольку оно не обладает кристаллическим строением. Твердые тела склонны противостоять внешним воздействием. Они могут быть преобразованы в жидкость путем нагрева. Температура замерзания воды при давлении в 1 атмосферу равна 0 °С, ниже которой она существует в виде льда.
Жидкость, в отличие от твердого тела, не обладает твердостью и не имеет определенной формы. У нее есть объем, и она принимает форму сосуда, в котором хранится. Внешнее воздействие вынуждает ее течь. Вода представляет собой жидкость между температурами замерзания и кипения (100 °С). Жидкости могут переходить в газообразную фазу при нагреве выше точки кипения.
Газ не имеет ни формы, ни определенного объема. Он принимает форму и занимает объем сосуда, в котором находится. Газ расширяется и сжимается с изменением температуры и давления и способен легко диффундировать в другие газы.

Точки кипения и замерзания
Аномальными свойствами воды являются ее необычно высокие температуры кипения и замерзания по сравнению с другими соединениями с аналогичной молекулярной структурой. Другие подобные вещества в обычных условиях являются газами. Ожидается, что вода с ее более низкой молекулярной массой, чем аналогичные соединения, должна иметь более низкие температуры кипения и замерзания. Однако из-за полярной природы ее молекулы и водородных связей температура ее кипения равна 100 °C, а замерзания – 0 °C. Для сравнения, соответствующие значения у сероводорода H2S равны -60 °C и -84 °C, у селеноводорода H2Se этот показатель составляет -42 °C и -64 °C и у теллуроводорода -2 °C и -49 °C.
Твердая фаза
Как правило, с понижением температуры вещества становятся более плотными, и вода не является исключением. Ее плотность при 25 °C составляет 0,997 г/мл и увеличивается с до максимальной (1 г/мл) при T = 4 °C. В метрической системе измерения килограмм определяется как масса 1 л воды с максимальной плотностью. Между 4 °C и точкой замерзания 0 °C происходит удивительная вещь, которая наблюдается у очень небольшого числа веществ. Вода постепенно расширяется, становясь менее плотной. Плотность льда при 0 °C составляет около 0,917 г/мл. Молекулы воды образуют кристаллы в форме тетраэдра (четырехсторонней фигуры, каждая грань которой представляет собой равносторонний треугольник). Поскольку плотность твердой фазы меньше, чем жидкой, лед плавает. При замораживании объем воды увеличивается на 1%.
Очень важно, что лед расширяется и плавает на поверхности. Из-за этого зимой лопаются водопроводы и появляются выбоины на дорогах. Замерзание и таяние воды в значительной степени ответственно за разрушение скал и образование почв. Кроме того, если бы озера и потоки замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.

Теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Например, летнее солнце на пляже нагревает песок до такой степени, что становится невозможно по нему ходить. Вода при этом остается прохладной. Оба вещества поглощают равное количество тепловой энергии, но температура песка выше. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Высокая теплоемкость воды делает ее хорошей охлаждающей жидкостью в конденсаторах и автомобильных радиаторах, предотвращающих двигатели от перегрева. Ее значение в 5 раз превышает теплоемкость песка и примерно в 10 раз – железа.
Умеренный климат в прибрежных районах является результатом поглощения в течение дня огромного количества солнечной тепловой энергии водой и медленного высвобождения ее ночью. Внутренние районы вдали от побережья обычно испытывают гораздо более высокие экстремальные температуры. Огромные океаны на Земле (около 75% площади поверхности) отвечают за смягчение климата на нашей планете, поддерживая существование жизни.
Теплота плавления и испарения
С теплоемкостью связана теплота фазового перехода. Это количество тепловой энергии, поглощаемой или высвобождаемой веществом, которое изменяется в фазе (от жидкого до твердого состояния, или наоборот, и от жидкого до газообразного, или наоборот) без изменения температуры. Необычайно высокие значения удельной теплоты плавления (332,4 кДж/кг) и испарения (2256,2 кДж/кг) – очередные аномальные физические свойства воды. При замерзании выделяется такое же количество тепла, которое поглощается в процессе плавления.

Практическим примером использования удельной теплоты плавления воды является использование льда для охлаждения напитков в изолированном кулере. В процессе таяния лед поглощает тепловую энергию напитков, сохраняя их прохладными. Емкость с водой в теплице в холодную зимнюю ночь смягчит температуру в помещении из-за тепла, выделяемого при замерзании. Конденсация пара высвобождает то же количество тепла, которое поглощается в процессе испарения. Удельная теплота испарения в 5 раз превышает теплоту, необходимую для повышения температуры от 0 до 100 °C. Аномальное свойство воды хранить большое количество накопленной тепловой энергии делает паровое отопление эффективным. В процессе конденсации пар высвобождает накопленную тепловую энергию. Дневная гроза в жаркий летний день – еще один пример высвобождения тепловой энергии в верхних слоях атмосферы при конденсации горячего влажного воздуха. Даже ураган является примером влияния перераспределения огромного количества тепловой энергии, поглощенной тропическими океанами.
Системы испарительного охлаждения работают наоборот. Вода в процессе испарения поглощает тепловую энергию из воздуха, охлаждая его.
Универсальный растворитель
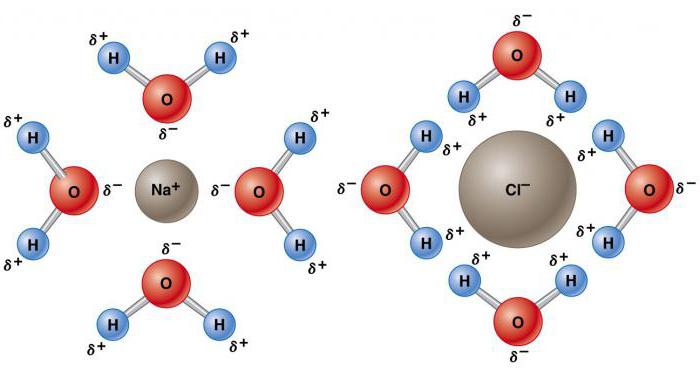
Растворитель способен растворять другое вещество с образованием гомогенной смеси (раствора) на молекулярном уровне. Еще одним аномальным свойством воды в химии благодаря ее полярной природе является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения и т. д. В воде растворяется больше веществ, чем в любом другом растворителе. В ней можно найти более половины известных химических элементов, некоторые в высоких концентрациях, а другие – только в следовых количествах. Например, концентрация насыщения хлорида натрия составляет около 36 г на 100 мл, а карбоната кальция – около 0,0015 г. Способность воды растворять вещество зависит от его химического состава, силы химических связей элементов, температуры и рН.
Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.

Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Это сила притяжения молекул, расположенных под поверхностью и тех, которые находятся на границе раздела жидкость-воздух. Она удерживает воду от растекания. Полярные соединения, как правило, имеют гораздо более высокое поверхностное натяжение, чем неполярные. И вода не является исключением. При 20 °С данный показатель равен 0,07286 Н/м (у этилового спирта – 0,0228 Н/м).
Без внешнего воздействия капля H2O принимает форму сферы, поскольку эта фигура обладает наименьшей площадью поверхности на единицу объема. Капли дождя являются крошечными пулями, которые при длительном воздействии разрушают горные породы. По этой же причине объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы – плавать.
Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Вода способна подниматься по стенкам стакана и других емкостей. Другие вещества, такие как масла, жиры, воск и синтетика (полипропилен и т. д.), не намокают. Они являются гидрофобными. Мембранные фильтровальные картриджи с размером пор менее 1 мкм изготавливают из гидрофобных полимеров с помощью смачивающих агентов, снижающих поверхностное натяжение воды, чтобы последняя могла проникнуть и оставаться в них. Это явление называется капиллярным эффектом. Он отвечает за движение воды в почве и по корням растений и крови по кровеносным сосудам.

Аномальные свойства воды и их значение для жизни
H2O является неотъемлемым компонентом существования всего живого. Это объясняет недавний интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Большинство живых существ содержат 70–80% H2O по весу.
Кроме того, вода играет значительную роль в процессе фотосинтеза. Растения используют лучистую энергию солнца для превращения воды и углекислого газа в углеводы: 6CO2 + 6H2O + 672 ккал → C6H12O6 + 6O2. Фотосинтез – самая основная и важная химическая реакция на Земле. Он поставляет питательные вещества, прямо или косвенно, всем живым организмам и является основным источником атмосферного кислорода.
Аномальные свойства воды и их причины
Способность элементов формировать соединения зависит от способности их атомов отдавать или принимать электроны. Элементы первого типа становятся положительно заряженными ионами (катионами), а второго – отрицательно заряженными анионами.
Способность элемента взаимодействовать с другими элементами для образования соединений называется валентностью. Она соответствует количеству полученных или отданных электронов. Для неорганических соединений алгебраическая сумма валентных чисел элементов равна нулю. Электростатическое притяжение противоположно заряженных ионов с образованием соединения называется ионной связью.
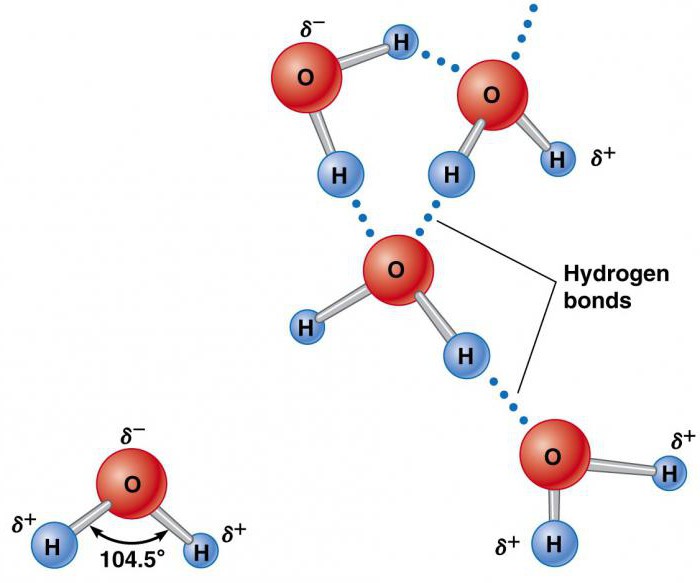
Элементы, которые образуют воду (водород и кислород), существуют отдельно в молекулах H2 и O2, содержащих по два атома. Они удерживаются вместе благодаря обмену электронной парой в химической связи, называемой ковалентной. Она намного сильнее ионной. Два атома, удерживаемые вместе ковалентной связью, образуют намного более устойчивую молекулу, чем ее составные части. В ней водород объединяется кислородом посредством общих электронных пар. Это уникальное распределение электронов в образованном химическом соединении заставляет атомы H располагаться по отношению к O под углом 104,5°.
Аномальные физические свойства воды объясняются ее структурой и химической связью.
Атом кислорода оказывает относительно сильное воздействие на общую пару электронов, в результате чего атомы водорода становятся электроположительными, а атом кислорода – электроотрицательной областью. Поскольку положительно и отрицательно заряженные участки распределены неравномерно по отношению к центральной точке, молекула воды является полярной.
Такая ее природа заставляет ее становиться электростатически привлекательной для других молекул H2O, а также ионов и контактных поверхностей с заряженными участками. Электроположительные атомы водорода притягиваются к электроотрицательным атомам кислорода соседних молекул воды. Это явление называется водородной связью. Ее прочность составляет всего около 10% ковалентной, но она отвечает за большинство аномальных физических свойств воды. К ним относятся высокие температуры замерзания и кипения, теплоемкость, удельная теплота плавления и испарения, растворимость и поверхностное натяжение.
Водородная связь отвечает за поддержание целостности молекулы H2O во время химических реакций. В то время как другие соединения подвергаются ионизации, сама вода сохраняет свою химическую целостность. Лишь относительно небольшое число молекул ионизируется в водород и гидроксильные ионы. Поэтому H2O является относительно плохим проводником электрического тока. Специфическое сопротивление теоретически чистой воды составляет 18,3 МОм∙см, в то время как питьевая имеет удельное сопротивление менее 10 000 Ом∙см. Таким образом можно легко проверить чистоту H2O.
Аномальные свойства воды объясняются наличием водородных связей, из-за которых имеет место низкая плотность льда. Вдоль них при замерзании располагаются молекулы, что приводит к расширению вещества. По этой причине лед плавает на поверхности воды. Повышенное давление снижает температуру плавления. Давление, создаваемое лезвием конька, топит лед, создавая слой, обеспечивающий изящное скольжение. Даже при чрезвычайно низких температурах высокое давление ослабляет кристаллическую решетку. Это является причиной того, что огромные ледяные массы, такие как ледники, постепенно движутся.
Дипольный момент
Полярная природа молекулы воды заставляет ее ориентироваться в электрическом или магнитном поле. Электроотрицательный атом кислорода выстраивается к положительному полюсу, а электроположительные атомы водорода – в направлении отрицательного. Вода имеет исключительно большой дипольный момент, представляющий собой произведение расстояния между зарядами, умноженное на величину заряда.
Диэлектрическая проницаемость является еще одним свойством, связанным с дипольным моментом. Молекулы воды путем выравнивания в электрическом поле стремятся нейтрализовать его и создать устойчивость к передаче электростатического заряда. Диэлектрическая проницаемость вещества определяется ε в уравнении F = Q1∙Q2/ε∙r2, где F – сила между двумя зарядами Q, разделенная расстоянием r в среде.
По мере увеличения диэлектрической проницаемости сила между зарядами уменьшается. Высокая диэлектрическая постоянная уменьшает силу притяжения ионов, что объясняет аномальные химические свойства воды растворять самые разнообразные вещества.
Заключение
Для людей вода – это обычное вещество, которое часто принимается как должное. Несмотря на то что аномальные свойств воды объясняются на атомном уровне, ее значение действительно велико. Очевидно, что она необходима для существования жизни на Земле. Аномальные свойства воды, кратко говоря, позволяют ей служить медиатором химических и биохимических процессов, формировать нашу природную среду и участвовать в создании климата и погоды.

