Какие аминокислоты содержатся в гистонах
Гисто́ны — обширный класс ядерных белков, выполняющих две основные функции: они участвуют в упаковке нитей ДНК в ядре и в эпигенетической регуляции таких ядерных процессов, как транскрипция, репликация и репарация. Существует пять различных типов гистонов H1/Н5, H2A, H2B, H3, H4. Гистоны H2A, H2B, H3, H4, называемые кóровыми гистонами (от англ. core — сердцевина), формируют нуклеосому, представляющую собой белковую глобулу, вокруг которой накручена нить ДНК. Гистон H1/H5, называемый линкерным гистоном (от англ. link — связь), связывается с внешней стороной нуклеосомы, фиксируя на ней нить ДНК. В хроматине гистоны составляют 25—40 % сухого веса[1]. Благодаря высокому содержанию лизина и аргинина гистоны проявляют сильно оснóвные свойства. Гистоны непосредственно контактируют с ДНК и способны нейтрализовать отрицательный заряд фосфатных групп ДНК за счёт положительных зарядов аминокислотных остатков. Последовательность аминокислот в этих белках является консервативной и практически не различается в организмах различных таксонов. Гистоны присутствуют в ядрах эукариотических клеток; у бактерий гистонов нет, но они выявлены у архей группы Euryarchaea[2].
Гистоны обнаружены в 1884 году немецким биохимиком Альбрехтом Косселем[3].
Структура нуклеосомы и гистоновых белков[править | править код]
Схематическое изображение структуры нуклеосомы
По две молекулы каждого из гистонов Н2А, Н2В, Н3 и Н4 составляют октамер, обвитый сегментом ДНК длиной 146 пар оснований (п.о.), образующим 1,8 витка спирали поверх белковой структуры. Эта частица диаметром 7 нм называется нуклеосомой. Участок ДНК, соединяющий соседние нуклеосомы и непосредственно не контактирующий с гистоновым октамером, взаимодействует с линкерным гистоном Н1. Длина фрагмента ДНК, приходящегося на одну нуклеосому, варьирует и составляет в среднем 200 п.о. При этом непосредственно с нуклеосомой связаны 146 п.о., а остальные несколько десятков соединяют две соседние нуклеосомы[4].
ДНК и нуклеосомные гистоны прочно соединены: в каждой нуклеосоме между ДНК и гистонами, входящими в её состав, образуется 142 водородные связи. Почти половина этих связей возникает между основной цепью аминокислот гистонов и фосфодиэфирными группами сахарнофосфатного остова ДНК. Помимо водородных связей ДНК с белками, нуклеосомы скрепляют многочисленные гидрофобные взаимодействия и солевые мостики. Например, положительные заряды аминокислот лизина и аргинина, которыми обогащены гистоны, могут эффективно нейтрализовать отрицательный заряд остова ДНК. Эти многочисленные взаимодействия отчасти объясняют, почему ДНК практически любой последовательности может быть связана с нуклеосомным октамером[5].
Структура кóровых гистонов[править | править код]
Кóровые гистоны Н2А, Н2В, Н3 и Н4 являются небольшими белками с молекулярными массами 10—15 кДа, состав которых чрезвычайно обогащён положительно заряженными аминокислотами лизином и аргинином[6]. Положительно заряженные аминокислоты сосредоточены в основном в аминных (N-) и карбоксильных (C-) (см. Пептидная связь) концевых частях молекул коровых гистонов, называемых хвостами. Гистоновые хвосты длиной около 15—30 аминокислотных остатков не организованы в какие-либо выраженные вторичные структуры. Гистоновые хвосты, прежде всего N-хвост, играют ключевую роль в эпигенетических механизмах, в которых участвуют эти белки. В центральных, самых консервативных, участках полипептидной цепи кóровых гистонов преобладают остатки гидрофобных аминокислот. Именно эти центральные области участвуют в образовании нуклеосомного октамера, на который навивается ДНК[3]. Центральная область всех нуклеосомных гистонов имеет характерную вторичную структуру с протяжённым α-спиральным доменом, который с обеих сторон фланкируется доменами, содержащими по одной петле и по одной короткой α-спирали. Эта пространственная структура называется гистоновой складкой (англ. histone fold domain, HFD)[7]. Таким образом, нуклеосомные гистоны содержат центральный структурированный трехспиральный HFD-домен и неструктурированные N- и C-хвосты.
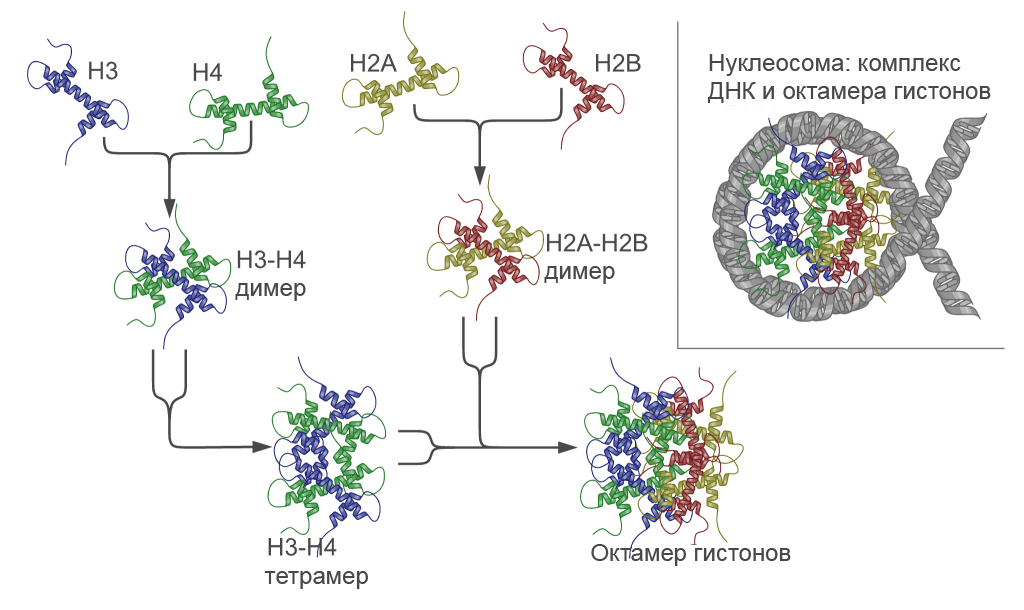
Гистоны H3 и H4, Н2А и H2B попарно узнают друг друга. Спиральные домены взаимодействуют между собой, образуя структуры, названные рукопожатием, в результате чего возникают гетеродимеры — Н3-Н4 и Н2А-Н2В. Из первого димера, в свою очередь, образуется тетрамер (Н3-Н4)2. Тетрамер (Н3-Н4)2 и два димера Н2А-Н2В составляют гистоновый октамер, сердцевину нуклеосомы[3]. Нуклеосома имеет клиновидную форму. Её узкую часть составляет (Н3-Н4)2, а широкая часть состоит из двух димеров Н2А-Н2В, которые расположены по бокам тетрамера (Н3-Н4)2 и не взаимодействуют друг с другом. Из всей ДНК, что намотана на нуклеосомный октамер, примерно 80 пар оснований связаны с тетрамером (Н3-Н4)2 и около 40 пар с димерами Н2А-Н2В[7].
Структура линкерного гистона H1/Н5[править | править код]
Линкерный гистон H5: вид в двух проекциях
С внешней стороной нуклеосомы в районе тетрамера (Н3-Н4)2 связывается линкерный гистон H1, фиксирующий тем самым на нуклеосоме нить ДНК. В эритроцитах птиц и рептилий в неактивном хроматине вместо гистона Н1 присутствует близкородственный гистон Н5[7]. Гистон Н1/Н5 существенно отличается от четырёх коровых гистонов. Он имеет молекулярную массу более 20 кДа. В его составе значительно больше остатков лизина, чем аргинина, причём все положительно заряженные аминокислотные остатки сконцентрированы на С-конце молекулы Н1. С-конец молекулы Н1 характеризуется неупорядоченной структурой и имеет длину около 100 аминокислотных остатков. Центральная часть молекулы Н1 богата гидрофобными аминокислотными остатками и в растворе образует глобулу. N-конец не имеет упорядоченной структуры и является относительно коротким[6].
Варианты гистонов[править | править код]
Каждый тип гистонов, кроме гистона H4, представляет собой группу, состоящую из канонических гистонов и гистоновых вариантов.
Роль гистоновых вариантов состоит в том, чтобы сохраняя нуклеосомную укладку хроматина, увеличивать или уменьшать её устойчивость, создавать особый контекст в каждом конкретном участке хроматина и тем самым управлять процессами транскрипции, репликации и репарации[7].
Гены гистонов[править | править код]
Гены классических гистонов присутствуют в геноме в нескольких копиях и собраны в тандемно повторённые кластеры. Кластерная организация генов канонических гистонов характерна для всех многоклеточных. У человека самый большой кластер этих генов, называемый HIST1 и состоящий из 55 генов, находится на хромосоме 6 в участке 6p21-p22. Два кластера меньших размеров находятся на хромосоме 1: в бэнде 1q21 находится кластер HIST2, содержащий 6 гистоновых генов, а в бэнде 1q42 находится кластер HIST3, состоящий из трёх генов. Вне трёх вышеописанных кластеров на хромосоме 12 в бэнде 12p13.1 находится единственный ген, кодирующий канонический коровый гистон, — ген HIST4H4, кодирующий гистон H4[8].
Характерной чертой генов канонических гистонов является отсутствие интронов. Транскрипция этих генов происходит строго во время S-фазы клеточного цикла. Матричная РНК этих генов не полиаденилируется, 3′-некодирующая часть мРНК уложена во вторичную структуру типа «стебель-петля»[9].
В противоположность генам канонических гистонов гены вариантных гистонов не образуют кластеров, они разбросаны по всему геному, нередко содержат интроны, транскрибируемая с них РНК полиаденируется, транскрипция происходит во время всего клеточного цикла.
| Суперсемейство | Семейство | Подсемейство | Гены |
|---|---|---|---|
| Линкерный гистон | |||
| Гистон Н1 | |||
| Вариантные гистоны H1 (подсемейство H1F) | H1F0, H1FNT, H1FOO, H1FX, HILS1 | ||
| Гены канонического гистона H1 в кластере HIST1 (H1H1) | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | ||
| Коровые гистоны | |||
| Гистон H2A | |||
| Вариантные гистоны H2A (H2AF) | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ | ||
| Гены канонического гистона H2A в кластере HIST1 (H2A1) | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | ||
| Гены канонического гистона H2A в кластере HIST2 (H2A2) | HIST2H2AA3, HIST2H2AC | ||
| Гистон H2B | |||
| Вариантные гистоны H2B (H2BF) | H2BFM, H2BFS, H2BFWT | ||
| Гены канонического гистона H2B в кластере HIST1 (H2B1) | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | ||
| Ген канонического гистона H2A в кластере HIST2 (H2B2) | HIST2H2BE | ||
| Гистон H3 | |||
| Гены канонического гистона H3 в кластере HIST1 (H3A1) | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | ||
| Гены канонического гистона H3 в кластере HIST2 (H3A2) | HIST2H3C | ||
| Гены канонического гистона H3 в кластере HIST3 (H3A3) | HIST3H3 | ||
| Гистон H4 | |||
| Гены канонического гистона H4 в кластере HIST1 (H41) | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | ||
| Ген канонического гистона H4 вне кластеров | HIST4H4 |
Модификации гистонов[править | править код]
Гистоны в октамере имеют подвижный N-концевой фрагмент («хвост») из 20 аминокислот, который выступает из нуклеосом и важен для поддержания структуры хроматина и контроля над генной экспрессией. Так, например, некоторые модификации гистонов (фосфорилирование и ацетилирование), как известно, локализованы преимущественно на участках хроматина с активными генами[10][11], тогда как их деацетилирование[12] и метилирование репрессорным комплексом поликомб играют важную роль в поддержании плюрипотентности и дифференцировке[13].
Детали механизма регуляции до конца не выяснены[14][15][16].
Консервативность гистонов[править | править код]
Последовательность аминокислот гистонов, то есть их первичная структура, мало изменилась в процессе эволюции. Это хорошо видно при сравнении аминокислотной последовательности гистонов млекопитающих, растений и дрожжей. Так, Н4 человека и пшеницы отличаются лишь несколькими аминокислотами. К тому же размер молекулы белка и её полярность довольно постоянны. Из этого можно заключить, что гистоны были оптимизированы ещё в эпоху общего предшественника животных, растений и грибов (более 700 млн лет назад). Хотя с тех пор в гистоновых генах происходили бесчисленные точечные мутации, все они, очевидно, приводили к вымиранию мутантных организмов.
См. также[править | править код]
- Белки группы polycomb
- CAF-1
- Хроматин
- Подавление экспрессии генов
- Гистонацетилтрансфераза
- Деацетилазы гистонов
- Нуклеосома
Примечания[править | править код]
- ↑ Биологический энциклопедический словарь / Гл.ред. М.С.Гиляров. — М.: Сов. энциклопедия, 1986. — 831 с.
- ↑ Нуклеиновые кислоты: от А до Я / Б. Аппель [и др.]. — М.: Бином: Лаборатория знаний, 2013. — 413 с. — 700 экз. — ISBN 978-5-9963-0376-2.
- ↑ 1 2 3 Карпов В.Л. От чего зависит судьба гена (рус.) // Природа. — Наука, 2005. — № 3. — С. 34—43.
- ↑ Коряков Д. Е. Модификации гистонов и регуляция работы хроматина // Генетика. — 2006. — Т. 42, № 9. — С. 1170—1185.
- ↑ Молекулярная биология клетки: в 3-х томах / Б. Альбертс, А. Джонсон, Д. Льюис и др. — М.-Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — Т. I. — С. 325—359. — 808 с. — ISBN 978-5-4344-0112-8.
- ↑ 1 2 Разин С. В. Хроматин: упакованный геном / С. В. Разин, А. А. Быстрицкий. — М.: БИНОМ: Лаборатория знаний, 2009. — С. 4-8. — 176 с. — ISBN 978-5-9963-0087-7.
- ↑ 1 2 3 4 Коряков Д. Е. Нуклеосомная организация хроматина // Эпигенетика / С. М. Закиян, В.В. Власов, Е. В. Дементьева. — Новосибирск: Изд-во СО РАН, 2012. — С. 7—30. — 592 с. — 300 экз. — ISBN 978-5-7692-1227-7.
- ↑ Marzluff W. F., Gongidi P., Woods K. R., Jin J., Maltais L. J. The human and mouse replication-dependent histone genes (англ.) // Genomics : journal. — Academic Press, 2002. — November (vol. 80, no. 5). — P. 487—498. — PMID 12408966. Архивировано 5 марта 2016 года. Архивная копия от 5 марта 2016 на Wayback Machine
- ↑ Marzluff W. F., Wagner E. J., Duronio R. J. Metabolism and regulation of canonical histone mRNAs: life without a poly(A) tail (англ.) // Nat. Rev. Genet. : journal. — 2008. — November (vol. 9, no. 11). — P. 843—854. — doi:10.1038/nrg2438. — PMID 18927579.
- ↑ Zheng Y. et al. Histone H1 phosphorylation is associated with transcription by RNA polymerases I and II (англ.) // The Journal of Cell Biology. — 2010. — Vol. 189, iss. 3. — P. 407. — doi:10.1083/jcb.201001148.
- ↑ Creyghton M. P. et al. Histone H3K27ac separates active from poised enhancers and predicts developmental state (англ.) // Proc Natl Acad Sci U S A. — 2010. — Vol. 107, iss. 50. — P. 21931—21936. — doi:10.1073/pnas.1016071107.
- ↑ Guang Hu, Paul A. Wade. NuRD and Pluripotency: A Complex Balancing Act (англ.) // Cell Stem Cell. — 2012. — Vol. 10, iss. 5. — P. 497—503. — doi:10.1016/j.stem.2012.04.011.
- ↑ Gerasimova A. et al. Predicting Cell Types and Genetic Variations Contributing to Disease by Combining GWAS and Epigenetic Data (англ.) // PLOS One. — Public Library of Science, 2013. — Vol. 8, iss. 1. — P. e54359. — doi:10.1371/journal.pone.0054359.
- ↑ Pengelly A. R. et al. A Histone Mutant Reproduces the Phenotype Caused by Loss of Histone-Modifying Factor Polycomb (англ.) // Science. — 2013. — Vol. 339, iss. 6120. — P. 698. — doi:10.1126/science.1231382.
- ↑ Histone Modification Controls Development: Chemical Tags On Histones Regulate Gene Activity
- ↑ Moyra Lawrence, Sylvain Daujat, Robert Schneider. How Histone Modifications Regulate Gene Expression (англ.) // Trends in Genetics. — Cell Press (англ.)русск., 2015. — Vol. 32, iss. 1. — P. 42—56. — doi:10.1016/j.tig.2015.10.007.
Ссылки[править | править код]
- HistoneDB 2.0 — Database of histones and variants at NCBI (англ.)
- Chromatin, Histones & Cathepsin; the proteolysis map (PMAP) — animation (англ.)
АМИНОКИСЛОТНЫЙ СОСТАВ НЕКОТОРЫХ ПРОТАМИНОВ, ГИСТОНОВ И РИБОНУКЛЕАЗЫ [71, 74-77, 98] [c.239]
Глобин принадлежит к группе гистонов, так как он растворяется в разбавленных кислотах (изоэлектрическая точка 7,5). Примерно одну пятую часть молекулы белка составляют основные аминокислоты, среди которых преобладает лизин. В большинстае гистонов преобладает аргинин. Аминокислотный состав гемоглобина лошади приведен в табл. 42 (стр. 657). Содержание серы (щистива) в глобинах колеблется IB гемоглобине лошади— 0,39%. в гемоглобине кошки — 0,62%, в гемоглобине курицы — 0,86%. Гемоглобин здорового взрослого человека так же, как и гемоглобин лошади, не содержит изолейцина фетальный гемоглобин (HbF) содержит примерно восемь остатков этой аминокислоты. Гемоглобин S, который находится в крови больных серповидной анемией (болезнь, характеризующаяся массовым распадом эритроцитов), является продуктом врожденного нарушения нормального метаболизма. Гемоглобин S значительно менее растворим, чем гемоглобин А, его изоэлектрическая точка лежит заметно выше (на [c.671]
АМИНОКИСЛОТНЫЙ СОСТАВ ГИСТОНА ХРОМАТИНА У РАСТЕНИЙ РАЗЛИЧНЫХ ВИДОВ [c.35]
Аминокислотный состав гистонов тимуса теленка [c.231]
Гистон Н1 существенно отличается от других гистонов. Он не входит в состав минимальных нуклеосом (см. раздел 4 этой главы) и участвует в организации 30-нм фибриллы хроматина. Его молекулярная масса превышает 20 ООО. Положительно заряженные аминокислотные остатки Н1, главным образом лизины, находятся в основном в С-конце молекулы и в меньшей степени в Ы-концевой части. Центральная область N-кoнцeвoй половины молекулы богата гидрофобными остатками и образует глобулу. Н1 обладает выраженной доменной структурой, мягкое расщепление трипсином легко делит его на глобулу и хвост . Помимо лизинов хвост богат остатками пролина и глицина и имеет неупорядоченную конформацию. [c.235]
Аминокислотный состав гистонных фракций из зобной железы теленка [c.139]
Данные об аминокислотной последовательности могут оказаться чрезвычайно информативными в тех случаях, когда что-то уже известно о функции белка, особенно если он взаимодействует с другими крупными биополимерами. Два примера белков такого рода (гистон и гликофорин) приведены на рис. 2.16. Гистоны прочно связываются с ДНК. Мы уже указывали, что большое число положительно заряженных аминокислот в гистонах, по-видимому, необходимо для стабилизации взаимодействия с таким полианионом. Как видно из рис. 2.16, у4, у Ы-конца последовательности находится необычный кластер положительно заряженных аминокислот. Напрашивается предположение, что этот участок имеет вытянутую конформацию и может спиралеобразно закручиваться вдоль довольно протяженного участка ДНК. Остальная часть белковой молекулы имеет обычный аминокислотный состав и, по-видимому, свертывается с образованием типичной глобулярной структуры. [c.73]
М Na2HP04. Если ДНК с помощью 1 М Na2HP04 элюировали после второй из упомянутых промывок оксиапатита, то она выходила в комплексе с прочно связанными с ней НБХ. Интересно, что аминокислотный состав этих НБХ необычен для основной пх массы остатки кислых аминокислот преобладают над остатками основных. Значит, прочная связь этой фракции НБХ с ДНК носит неионный характер (поэтому их не снимает 3 М Na l). Предполагалось, что такие белки связаны в малой канавке ДНК, свободной от гистонов. Число их невелико — электрофорез выявляет шесть главных белков с молекулярными массами 22, 28, 32, 56, 66 и 71 тыс. Дальтон. [c.236]
Встречаются гистоны двух типов — богатые аргинином и богатые лизином [165—172]. В зобной железе теленка отношение между первыми и вторыми составлят 9 1. Аминокислотный состав гистонов этой ткани приведен в табл. 12. [c.138]
Гистоны также представляют собой белки, обладающие основными свойствами. Эти белки были открыты Косселем [184] в ядрах клеток, где они находятся в соединении с нуклеиновыми кислотами. Основной характер выражен у гистонов слабее, чем у протаминов, вследствие чего они не осаждаются щелочными растворами пикратов. Возможно, что гистоны являются предшественниками протаминов, так как они были найдены в семенниках неполовозрелых рыб. В силу своего щелочного характера гистоны осаждаются из растворов аммиаком при изоэлектрической точке (около pH 8,5). Это свойство используется при выделении гистонов. Подробнее всего изучен гистон из зобной железы. Для получения этого гистона измельченная зобная железа настаивается с водой, после чего к водному экстракту железы прибавляют уксусную кислоту. При этом выпадает осадок ну-клеогистона, который растворяют в щелочи. Нуклеиновые кислоты удаляют осаждением серной кислотой, а образующуюся сернокис-яую соль гистона осаждают из фильтрата этиловым спиртом [185]. Гистоны имеют более высокий молекулярный вес, чем протамины, и аминокислотный состав гистонов ближе к аии- [c.198]
Белки разделяются на две большие группы протеины, или простые белки, молекулы которых состоят из одних аминокислот, и протеиды, или сложные белки, распадаюшиеся при гидролизе на аминокислоты и небелковую часть различной природы. В зависимости от аминокислотного состава и некоторых других свойств протеины в свою очередь делятся на альбумины, глобулины, гистоны, протамины и склеропротеины. В зависимости от характера небелковой части протеиды разделяются на н у к л е о п р о те и д ы, содержащие кроме белка так называемые нуклеиновые кислоты хромопротеиды, в состав которых входят красящие вещества глюкопротеиды, содержащие различные производные углеводов фосфопротеиды, характеризующиеся наличием фосфорной кислоты, непосредственно связанной с молекулой белка, а не через нуклеиновые кислоты, как у нуклеопротеидов, и липопротепды, содержащие жиры. [c.51]
В первых опытах Мишера по выделению нуклеина из клеток гноя, проведенных около века назад, было установлено, что в ядрах эукариотов отрицательно заряженная ДНК находится в комплексе с примерно равным по массе количеством положительно заряженных основных белков. В своей работе, проведенной в начале века, Коссель установил не только природу химических компонентов ДНК, но также выяснил состав связанных с ДНК основных белков. Из этих белков наиболее важное значение имеют гистоны, которые представляют собой полипептидные цепи длиной от 50 до 200 аминокислотных остатков. Положительный заряд ги-стонов обусловлен высоким содержанием в них трех основных аминокислот аргинина, лизина и гистидина, в боковых цепях которых имеется вторая аминогруппа (фиг. 15) па их долю приходится почти 25% всех аминокислот гистонов. Интересно сравнить высокое содержание основных аминокислот в гистонах с данными об аминокислотном составе различных белков, представленными в табл. 2, из которых видно, что основные аминокислоты составляют лишь от 8 до 12% всех аминокислотных остатков таких белков, как р-галактозидаза, А-полипептид триптофан-синтазы Е. oli и бычий инсулин. Взаимодействие между ДНК и гистонами в хромосоме происходит, вероятно, благодаря образованию ионных связей между фосфатными группами полинуклеотидной цепи и боковыми аминогруппами полипептидной цепи. На долю ДНК и гистонов приходится около 3 всей массы большинства хромосом остальную часть обычно относят на счет негистонных белков и РНК. [c.498]
Пять типов гистонов можно разделить на две основные группы 1) нуклеосомные гистоны и 2) П1 гистоны. Пуклеосомные гистоны — это небольшие белки (102-135 аминокислотных остатков), отвечающие за формирование нуклеосом. К ним относятся четыре гистона П2А, П2В, ПЗ и Н4. ПЗ и П4 образуют внутреннюю часть нуклеосомы и. как установлено, являются наиболее консервативными из известных белков например, аминокислотные последовательности гистонов П4 у гороха и коровы различаются всего лишь по двум аминокислотным остаткам (рис. 9-21). Такая эволюционная стабильность предполагает, что почти каждая аминокислота, входящая в состав таких белков, играет важную роль, и изменение в любом положении может оказаться вредным для клетки [c.111]
В связи с установлением трехмерной структуры гистонового октамера (Н2А-Н2В-НЗ-Н4)2 и его стерических взаимоотношений с ДНК встает ряд вопросов принципиального порядка. Например, каковы механизмы и причины спонтанного возникновения белкового комплекса и самосборки нуклеосомы в целом Не менее интересен и вопрос о том, каким образом происходит освобождение нуклеотидной цепи от гистонового кора Дело в том, что доступность ДНК, входящей в состав нуклеосом, существенно ограничена на тех участках, где двойная спираль соприкасается с поверхностью октамера. Присоединение специфических регуляторных белков к функционально активным нуклеотидным последовательностям становится возможным только при освобождении соответствующих участков связывания ДНК от нуклеосом. Поэтому выяснение причины распада нуклеопротеиновых комплексов столь же важно, как и исследование причины их возникновения. Можно полагать, что после того, как механизм создания и разрушения нуклеосом получит свою количественную трактовку, будет решен и один из наиболее интригующих вопросов, касающихся гистоновых белков, а именно, почему гистоны Н2А, Н2В, НЗ и Н4 в отношении своих аминокислотных последовательностей являются самыми консервативными в природе белками (табл. 1.7) Не исключено, что нуклео-сома представляет собой уникальную по своей структурной организации клеточную субъединицу. Из общих соображений очевидно, что в ней должны сочетаться идеальная согласованность внутри- и межмолекулярных взаимодействий белков, образующих гистоновый октамер, комплементарность поверхности нуклеосомного кора контактной поверхности суперспирали ДНК и в то же время наличие тонкого баланса сил противоположной направленности, нарушение которого при соответствующих изменениях внешних условий ведет к быстрому смещению равновесия в сторону возникновения или распада нуклеопро-теинового комплекса. Консервативность гистонов Н2А, Н2В, НЗ и Н4 указывает на то, что нормальное функционирование такой системы практически исключает аминокислотные замены. [c.112]
В состав гистонов входят модифицированные аминокислотные остатки, например О-фосфосерин, моно-, ди- и тpи-6-N-мeтиллизин, e-N-ацетиллизин и различные метилированные производные аргинина. Возможная роль гистонов и значение модифицированных остатков обсуждаются ниже (гл. 25). [c.232]
