Какая масса содержится в растворе если на нейтрализацию

Задание 155.
Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOН? Каков титр раствора NaOН? Ответ: 0,882 г; 0,0 16 г/см3.
Решение:
Эквивалентная масса HNO3 равна : МЭ(HNO3) = М(HNO3)/1 = 63/1 = 63 г/моль. Эквивалентная масса NaOH равна : МЭ(NaОН) = М(NaОН)/1 = 40/1 = 40 г/моль. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим число эквивалентов NaOН , содержащихся в 35 см3 его раствора из пропорции:
1000 : 0,4 = 35 : х; х = (0,4 . 35)/1000 = m0,014Н.
Из закона эквивалентов следует, что вещества реагируют друг с другом в эквивалентных соотношениях. Находим массу HNO3 по формуле:
m(HNO3) = МЭ(HNO3) . СН(HNO3) = 63 . 0,014 = 0,882 г
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу гидроксида натрия, содержащегося в 1 л 0,4Н раствора его:
m(NaOH) = МЭ(NaOH) . СН(NaOH) = 40 . 0,4 = 16 г.
Отсюда
Т(NaOH) = 16/1000 = 0,016 г/см3.
Можно титр раствора рассчитать, зная концентрацию эквивалента (СН) и массу эквивалента (МЭ) растворённого вещества по формуле:
Т = СН .МЭ(В)/1000;
Т(NaOH) = 0,4 . 40/1000 = 0,016 г/см3.
Ответ: 0,882 г; 0,0 16 г/см3.
Приготовление раствора
Задание 156.
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Решение:
Для расчета используем формулу:
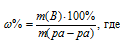
m(B) – масса растворённого вещества; m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Обозначим массу растворённого вещества через х и подставим данные задачи в уравнение, получим искомую массу NaNO3:
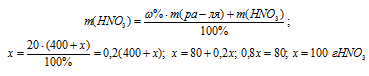
Ответ: 100 г.
Массовая доля раствора
Задание 157.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaСI. Чему равна массовая доля полученного раствора? Ответ: 32,5%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(20%) = 300 .20/100 = 60 г;
m(40%) = 500 . 40/100 = 200 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
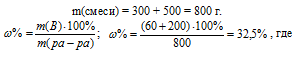
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 32,5%.
Задание 158.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(62%) = 247 .62/100 = 153,14 г;
m(18%) = 145 .18/100 = 26,1 г;
m(H2SO4) = 153,14 + 26,1 = 179,24 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
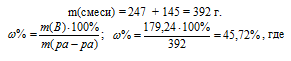
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 45,72%.
Задание 159.
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Решение:
Находим массу серной кислоты в растворе:
m(H2SO4) = (700 .60)/100 = 420 г.
Находим массу раствора после выпаривания:
m(ра-ра) = 700 – 200 = 500 г.
Находим массовую долю оставшегося раствора из формулы:
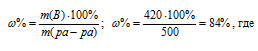
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 84%.
Задание 160.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ. 16,7%.
Решение:
Находим массу соли, содержащуюся в растворе:
m(соль) = (10000 .20)/100 = 2000 г.
Находим массу соли после выпаривания:
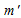 (ра-ра) = 2000 – 400 = 1600 г.
(ра-ра) = 2000 – 400 = 1600 г.
Находим массу раствора после охлаждения:
m(ра-ра) = 10000 – 400 = 9600 г.
Находим массовую долю оставшегося раствора из формулы:
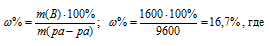
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ. 16,7%.
Задание 155.
Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOН? Каков титр раствора NaOН? Ответ: 0,882 г; 0,0 16 г/см3.
Решение:
Эквивалентная масса HNO3 равна : МЭ(HNO3) = М(HNO3)/1 = 63/1 = 63 г/моль. Эквивалентная масса NaOH равна : МЭ(NaОН) = М(NaОН)/1 = 40/1 = 40 г/моль. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим число эквивалентов NaOН , содержащихся в 35 см3 его раствора из пропорции:
1000 : 0,4 = 35 : х; х = (0,4 . 35)/1000 = m0,014Н.
Из закона эквивалентов следует, что вещества реагируют друг с другом в эквивалентных соотношениях. Находим массу HNO3 по формуле:
m(HNO3) = МЭ(HNO3) . СН(HNO3) = 63 . 0,014 = 0,882 г
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу гидроксида натрия, содержащегося в 1 л 0,4Н раствора его:
m(NaOH) = МЭ(NaOH) . СН(NaOH) = 40 . 0,4 = 16 г.
Отсюда
Т(NaOH) = 16/1000 = 0,016 г/см3.
Можно титр раствора рассчитать, зная концентрацию эквивалента (СН) и массу эквивалента (МЭ) растворённого вещества по формуле:
Т = СН .МЭ(В)/1000;
Т(NaOH) = 0,4 . 40/1000 = 0,016 г/см3.
Ответ: 0,882 г; 0,0 16 г/см3.
Приготовление раствора
Задание 156.
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Решение:
Для расчета используем формулу:
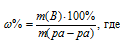
m(B) – масса растворённого вещества; m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Обозначим массу растворённого вещества через х и подставим данные задачи в уравнение, получим искомую массу NaNO3:
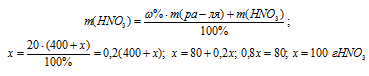
Ответ: 100 г.
Массовая доля раствора
Задание 157.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaСI. Чему равна массовая доля полученного раствора? Ответ: 32,5%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(20%) = 300 .20/100 = 60 г;
m(40%) = 500 . 40/100 = 200 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
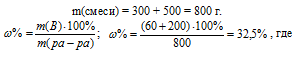
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 32,5%.
Задание 158.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(62%) = 247 .62/100 = 153,14 г;
m(18%) = 145 .18/100 = 26,1 г;
m(H2SO4) = 153,14 + 26,1 = 179,24 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
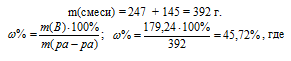
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 45,72%.
Задание 159.
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Решение:
Находим массу серной кислоты в растворе:
m(H2SO4) = (700 .60)/100 = 420 г.
Находим массу раствора после выпаривания:
m(ра-ра) = 700 – 200 = 500 г.
Находим массовую долю оставшегося раствора из формулы:
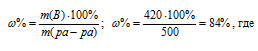
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ: 84%.
Задание 160.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ. 16,7%.
Решение:
Находим массу соли, содержащуюся в растворе:
m(соль) = (10000 .20)/100 = 2000 г.
Находим массу соли после выпаривания:
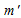 (ра-ра) = 2000 – 400 = 1600 г.
(ра-ра) = 2000 – 400 = 1600 г.
Находим массу раствора после охлаждения:
m(ра-ра) = 10000 – 400 = 9600 г.
Находим массовую долю оставшегося раствора из формулы:
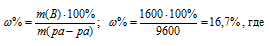
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); — массовая доля растворённого вещества в процентах.
Ответ. 16,7%.
Бэла, помогите пожалуйста с задачей
На нейтрализацию 1,125 г щавелевой кислоты h2с2о4 потребовалось 1 г гидроксида натрия. Найти молярную эквивалентную массу кислоты

Ханна,
Задача 180
На нейтрализацию 1,125 г щавелевой кислоты Н2С2О4 потребовалось 1 г гидроксида натрия. Найти молярную эквивалентную массу кислоты.
Решение:
Мэ гидроксида натрия равна сумме экв. масс натрия и гидроксильной группы, т.е. 23+17=40 г-экв/моль
Мэ(Н2С2О4) = Мэ(Н2С2О4) ∙ m(Н2С2О4) / m(NaOH) = 1,125 г ∙ 40 г-экв/моль / 1 г = 45 г-экв/моль
Помогите пожалуйста !
1)какой объем 0.15 н раствора HCL требуется для нейтрализации 0.25 г химичиски чистого тетрабората натрия?
2) какой индикатор нужно взять при титрование щавельный кислоты раствором карбоната натрия?

Зулёк,
Задача 181
Какой объем 0.15 н раствора HCl требуется для нейтрализации 0.25 г химичиски чистого тетрабората натрия?
Решение:
V= nэ / Cн
nэ (HCl) = nэ (Na2B4O7)
nэ= m / Mэ
Mэ = M / z = M ∙ fэкв
V(HCl) = m(Na2B4O7) ∙ z(Na2B4O7) / (Cн(HCl) ∙ М(Na2B4O7)) = 0.25 ∙ 2 / (0.15 ∙ 201) = 0,0166 л (16,6 мл)
помогит решить пожалуйста!
рассчитать массовую долю химически чистой буры NA2B4O7*10H2O в загрязненном образце,если навеску ее в 0,8750 г при титровании идет 20,40 мл 0,2120 н раствора HCL
помогите пожалуйста решить задачи
1)Чому дорівнюе молярна концентрация розчину гидроксиду натрию,якщо на титрування 20,00мл 0,1985 М розчину HCL йде 16,33 мл розчину NaOH?
2)На титрування 0,7863 г бури йде 20,63 мл розчину HCL .Іншим аналізом встановлено обємне співвідношення розчинів V(HCl)V(NaOH)=1,022.Обчислити:а)C(HCl) б)С(NaOH)???
3)Розрахувати молярну концентрацію HCl,якщо на титрування 0,4668 г Na2B4O7 умноженно на 10Н2О(бури) затрачено 18,38 мл цього розчину??
4)З 40г реактиву NaOH?який містить 3% Na2CO3 ы 7% ынших індиферентних домішок,приготували 1лрозчину.Обрахувати молярну концентрацію розчину лугу,якщо вважати,що Na2CO3 титрується до H2CO3?
5)Який обьєм розчину Na2CO3,густина якого 1,105 г/см3,треба відібрати для приготування:а)1л розчину з Т(Na2CO3)=0,0050 г/мл;б)1л розчину з Т(Na2CO3/HCl)=0.0030г/мл.
Помогите пожалуйста решить задачу, Какой объем КОН с титром 0,01111 требуется для нейтрализации 25,00 мл раствора НСL c титром 0,00777?
буду очень благодарна)))
Помогите, пожалуйста
Рассчитать массу гидроксида натрия содержащего в р-ре, на третирование которого затрачено а) 15,00 мл р-ра H2SO4 с титром 0,006734 г/мл, б) 15,00 мл р-ра H2SO4 с титром по NaOH 0,006734 г/мл

Помогите решить, пожалуйста. Чему равно содержание граммов хлороводородной кислоты в образце, если на титрование го пошло 10,50 мл раствора NaOH? Т NaOH/HCL= 0,00383 г/мл.

Паша,
Задача 182
Рассчитать массовую долю химически чистой буры NA2B4O7*10H2O в загрязненном образце, если на ее навеску в 0,8750 г при титровании идет 20,40 мл 0,2120 н раствора HCl.
Решение:
nэ (Na2B4O7*10H2O) = nэ (HCl) = V(л)∙Cн
m (Na2B4O7*10H2O) реаг. = nэ ∙ Mэ
Mэ = M / z = M ∙ fэкв
z (Na2B4O7*10H2O) = 2 (fэкв=1/2)
ω = m реаг. / m навески = V(HCl) ∙ Cн(HCl) ∙ M(Na2B4O7*10H2O) ∙ fэкв(Na2B4O7*10H2O) / m нав. = 20,40 мл ∙ 0,2120 моль/л ∙ 381,4 г/моль / (2 ∙ 0,8750 г ∙ 1000 мл/л) = 09426 (94,26%)
Марина, прочтите правила группы, 1-я тема

Салават,
8. С(HCl) = C(NaOH) ∙ V(NaOH) / V(HCl) = 0.3 ∙ 10.00 / 15.00 = 0.2 M

Ирина,
Задача 183
Какой объем КОН с титром 0,01111 г/мл требуется для нейтрализации 25,00 мл раствора HCl c титром 0,00777 г/мл?
Решение:
V(КOH) = C(HCl) ∙ V(HCl) / С(КOH)
Титр раствора (г/мл) Т=0,001См ∙ М → С = 1000Т/М
V(КOH) = Т(HCl) ∙ V(HCl) ∙ М(КОН) / Т(КОН) ∙ М(HCl) = 0,00777 ∙ 25,00 ∙ 56,11 / (0,01111 ∙ 36,46) = 269,3 мл

Никита,
Задача 184
Решение:
Обозначим Vф — объем щелочи, необх. для титрования H3PO4 до NH2PO4-,
Vс — объем щелочи, необх. для титрования HCl.
При титровании с метиловым оранжевым титруется HCl (Vс) и H3PO4 до NaH2PO4 (Vф);
Vс + Vф = 11,40 мл
При титровании с фенолфталеином титруется HCl (Vс) и H3PO4 до Na2HPO4 (2Vф);
Vс + 2Vф = 21,70 мл
Отсюда Vф = 21,70 — 11,40 = 10,30 мл, Vс = 11,40 — 10,30 = 1,100 мл
Расчет массы кислоты в 50 мл смеси:
m = n ∙ M
n = V(NaОН, л) ∙ С(NaОН) ∙ 50 ∙ Vобщ. р-ра / (V исх. смеси ∙ Vпробы)
m(к-ты) = Vc, л ∙ C(NaОН) ∙ М(к-ты) ∙ 50 ∙ Vобщ. р-ра / (V исх. смеси ∙ Vпробы)
m(HCl) = 1,100 ∙ 0,1012 ∙ 36,46 ∙ 50 ∙ 250 /(10 ∙ 6,25 ∙ 1000) = 0,8117 г
m(H3PO4) = 10,30 ∙ 0,1012 ∙ 98,00 ∙ 50 ∙ 250 /(10 ∙ 6,25 ∙ 1000) = 20,43 г

Надя, за что ж вы раствор ТРЕТИРОВАЛИ? что он вам плохого сделал? )))
Задача 185
Рассчитать массу гидроксида натрия, содержащегося в р-ре, на ТИТРОВАНИЕ которого затрачено: а) 15,00 мл р-ра H2SO4 с титром 0,006734 г/мл, б) 15,00 мл р-ра H2SO4 с титром по NaOH 0,006734 г/мл.
Решение:
m=nэ ∙ Mэ
Mэ = М / z = М ∙ f экв.
f экв. кислоты = основности, f экв. щелочи = кислотности.
а) Титр T=m/V (г/мл)
m(H2SO4) = T ∙ V
nэ(NaOH) = nэ(H2SO4) = m(H2SO4) / Мэ(H2SO4) = T ∙ V / Мэ(H2SO4)
m(NaOH)=nэ ∙ Mэ = T ∙ V ∙ Mэ(NaOH) / Мэ(H2SO4) = 0,006734 ∙ 15,00 ∙ 40,00 / 49,04 = 0,08239 г
б) Условный титр T(A/B) = T(A) ∙ Mэ(B) / Mэ(A)
T(H2SO4/NaOH) = T(H2SO4) ∙ Mэ(NaOH) / Mэ(H2SO4)
m(NaOH) = T(H2SO4/NaOH) ∙ V(H2SO4) = 0,006734 ∙ 15,00 = 0,1010 г
Как видите, условный титр намного удобнее для расчетов.
Бэлла помогите пожалуйста))
Рассчитать эквивалентную концентрацию циркония в растворе если на титрование 10 мл этого раствора с хромогеном черным до синей окраски пошло 5,75 мл 0,05 н раствора трилона Б. Пожалуйста
Помогите пожалуйста)
Какая масса кальция содержится в 200 мл раствора хлорида кальция если на титрование 20 мл его пошло 10 мл 0,02 н раствора трилона б
для определения содержания ионов железа(III) сухая навеска глины 0,8644 г переведена в раствор и помещена в мерную колбу вместимость 250см3
В 100 см3 полученного раствора железо(III) было востановлено до
железа(II) и oттитрировано 9,50 см3 раствора перманганата калия с молярной
концентрацией эквивалента 0,0l моль/дм3 и Kn=l,1140, Рассчитайте, мaccoвyю долю (%) оксида железа (III) в cyxoй пробе.
помогите пожалуйста с решением этой задачи!!

Зулёк,
Задача 186
Рассчитать эквивалентную концентрацию циркония в растворе если на титрование 10 мл этого раствора с хромогеном черным до синей окраски пошло 5,75 мл 0,05 н раствора трилона Б.
Решение:
Независимо от заряда катиона, в реакции комплексообразования принимает участие один катион и один анион (fэ=1). Поэтому:
С(Zr2+) = С(ТБ) ∙ V(ТБ) / V(Zr2+) = 5,75 ∙ 0,05 / 10,0 = 0,0288 н

Паша,
Задача 187
Какая масса кальция содержится в 200 мл раствора хлорида кальция если на титрование 20 мл его пошло 10 мл 0,02 н раствора трилона Б?
Решение:
Независимо от заряда катиона, в реакции комплексообразования принимает участие один катион и один анион. Поэтому молярные массы эквивалента титранта и определяемого катиона равны их молярным массам (fэ=1).
m(Ca2+) = n ∙ M = C(ТБ) ∙ V(ТБ, л) ∙ M(Ca) ∙ V (p-pa)/ V (пробы)=
= 0,02 ∙ 10 ∙ 10^-3 ∙ 40 ∙ 200/ 20=0,08 г
- Главная
- Вопросы & Ответы
- Вопрос 2156461
 Гость:
Гость:
6 лет назад
39
1
Лучший ответ:


Гость:
Если будут вопросы с почерком обращайся
6 лет назад
Ваш ответ (не менее 20 символов):
Ваше имя (не менее 2 символов):

Лучшее из галереи:































Другие вопросы:
 Гость:
Гость:
Спортивный магазин проводит акцию: «Любая футболка по цене 300 рублей. При покупке двух футболок — скидка на вторую 60%». Сколько рублей придётся заплатить за покупку двух футболок?
6 лет назад
Смотреть ответ
19
1
 Гость:
Гость:
Цена деления шкалы 100 200 300 400 500,
6 лет назад
Смотреть ответ
8
1
 Гость:
Гость:
история создания стихотворения » Я помню чудное мгновенье»
6 лет назад
Смотреть ответ
12
1
 Гость:
Гость:
Помогите вставить артикли и предлоги 🙂
6 лет назад
Смотреть ответ
6
1
 Гость:
Гость:
1.Составьте хронологию событий Украинской революции
6 лет назад
Смотреть ответ
6
1
- Главная
алгебра
Есть ответ: 0,882г; 0,016г/см^3.
Напишите, пожалуйста, решение.
кет5и
26 янв. 2016 г., 9:34:19 (4 года назад)
Настя210289
26 янв. 2016 г., 12:18:04 (4 года назад)
если будут вопросы с почерком обращайся
Ответить
Другие вопросы из категории
Irisha40 / 17 янв. 2016 г., 2:24:15
Срочно!!!
Вычисли массу серной кислоты, которая образ. из оксида серы (6) массой 8 г.
Zinchik / 11 янв. 2016 г., 23:52:59
задание по химии 9 кл
Zn+CI2 = ZnCi2
Zn+2HCI=ZnCI2+H2
нужно Проставьте под знаками соответствуйщих химич. элементов степени окисления и покажите переход электронов
помогите плиз..
Читайте также
жановна / 01 июля 2013 г., 8:38:56
1. какая масса угольной кислоты образуется в результате взаимодействия 2,5 моль оксида углерода (4) с водой?
2. Какую массу оксида магния можно добывать, если разложить 4 моль гидроксида магния?
3. Какое количество вещества гидроксида натрия можно получить при взаимодействии 24,8 г оксида натрия с водой?
4. Вычислить количество оксида серы (4), который можно получить при горении серы, если расходуется 51,2 г кислорода.
5. Какой объем оксида углерода (4) можно получить при сгорании 3 моль углерода?
6. При окислении кальция создал оксид кальция количеством вещества 3 моль. Какой объем кислорода при этом потратится?
7. Записать уравнения реакций по навединимы схемам. Отметить тп реакции:
8. S + O2 =
K + HCl =
Na2O + H2O =
Fe (OH) 3 =
Ca + O2 =
Li + H2SO4 =
CO2 + H2O =
Fe (OH) 2 =
9. Вычислить массовые доли элементов в оксиде серы (4).
10. Вычислить массовые доли элементов в меди (2) ксиди.
Machkill / 20 янв. 2015 г., 11:14:17
1. Какой объем водорода можно получить, если на хлороводорода кислоту подействовать цинком массой 13 г? 2. Вычислить объем водорода, кий нужно взять
для восстановления меди массой 32 г из оксида меди. 3. Вычислить количество угольной кислоты, которая образуется в результате взаимодействия оксида углерода (4) с водой: а) количеством вещества 3 моль б) массой 36 г. 4. Какая масса оксида калия взаимодействует с водой, если в результате реакции образуется гидроксид калия количеством вещества 2,5 моль? 5. Какой объем водорода требуется для восстановления 3 моль меди из оксида меди (2) и какая масса воды при этом образуется? 6. Какую массу оксида железа (2) можно восстановить водородом объемом 8,96 л? 7. Какая масса оксида фосфора (5) взаимодействует с водой, если в результате рефкции образуется цель фосфорная кислота количеством вещества 2,5 моль? 8. Какой объем водорода выделится при взаимодействует с водой кальция количеством вещества 1,5 моль? 9. Какая масса серной кислоты израсходуется на взаимодействие с оксидом калия массой 18,8 г? 10. Количество вещества соли сульфата алюминия образуется в результате взаимодействия оксида алюминия с серной кислотой массой 19,6 г? 11. Какую массу оксида меди можно получить в результате прокаливания гидроксида меди массой 19,6 г? Т Если что-то из того знаешь пожалуйста помоги буду благодарна! :))
Вы находитесь на странице вопроса «Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см^3 0,4 нормалей раствора NaOH? Каков титр раствора NaOH?«, категории «химия«. Данный вопрос относится к разделу «5-9» классов. Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории «химия«. Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
