Какая масса серной кислоты содержится в 1 литре 5 н раствора
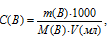
Задача 421.
Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1л 0,25 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
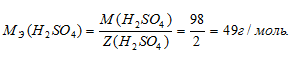
Рассчитаем массу H2SO4 в 1л 0,25н раствора по формуле:
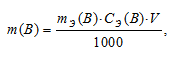
где
m(B) — масса вещества; mЭ(В) — молярная масса эквивалента вещества, г; СЭ(В) — эквива-лентная концентрация или нормальность; V — объём раствора.
Отсюда
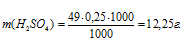
Теперь рассчитаем массу раствора, если известны массовая доля H2SO4 (96%) и масса H2SO4 (12,25г) по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
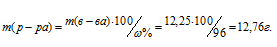
Определим объём раствора H2SO4, необходимого для приготовления 1л 0,25н раствора по формуле: m = pV, где p — плотность раствора, V — объём раствора.
Тогда
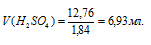
Ответ: 6,93 мл.
Задача 422.
Сколько миллилитров 0,5М раствора H2SO4 можно приготовить из 15 мл 2,5М раствора?
Решение:
Для нахождения массы серной кислоты, содержащейся в 15мл 2,5М раствора, можно определить по формуле:
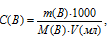
где
С(В) – молярная концентрация вещества (В), m(B) – масса растворённого вещества (В), М(В) – молярная масса вещества (В), V – объём раствора.
Тогда
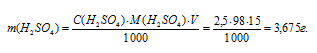
По этому же уравнению рассчитаем объём раствора, который можно приготовить из 3,675г H2SO4:
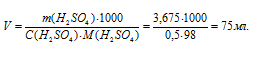
Ответ: 75мл.
Задача 423.
Какой объем 0,1М раствора H3PO4 можно приготовить из 75 мл 0,75н. раствора?
Решение:
Для решения задачи используем формулы:
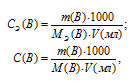
где
СЭ(В) – молярная концентрация эквивалента вещества (В);
С(В) — молярная концентрация вещества (В);
МЭ(В) – молярная масса эквивалента вещества (В);
M(B) — молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Определим молярную массу эквивалента H3PO4 из соотношения:
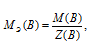
МЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(В) — эквивалентное число; Z(кислоты) равно числу ионов H+ в H3PO4 → 3.
Отсюда
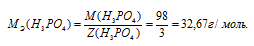
Рассчитаем массу ортофосфорной кислоты:
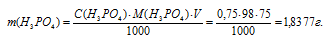
Определим объём раствора H3PO4, необходимого для приготовления раствора:
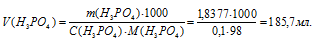
Ответ: 185,7мл.
Задача 424.
Какой объем 6,0М раствора НСI нужно взять для приготовления 25 мл 2,5М раствора НСI?
Решение:
Для нахождения массы соляной кислоты, содержащейся в 25 мл 2,5М раствора, а также объёма 6,0М раствора можно использовать формулу:
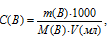
С(В) — молярная концентрация вещества (В);
M(B) — молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Тогда
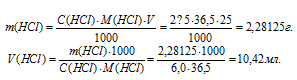
Ответ: 10,42мл.
Задача 425.
Плотность 40%-ного (по массе) раствора HNO3 равна 1,25г/мл. Рассчитать молярность и моляльность этого раствора.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Массу HNO3, содержащуюся в 1 литре раствора, рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
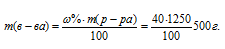
Молярную концентрацию раствора (CM) получим делением числа граммов HNO3 в 1л раствора на молярную массу HCl (36,5г/моль):
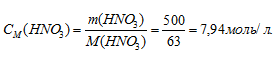
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:
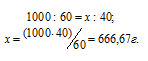
Теперь рассчитаем моляльность раствора:
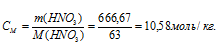
Ответ: 7,94 моль/л; 10б=,58 моль/л.
Задача 426.
Вычислить массовую долю гидроксида натрия в 9,28н. растворе NaOН (р = 1,310г/мл).
Решение:
Найдём массу NaOН, содержащуюся в 1000 мл раствора из пропорции:
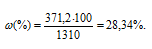
Масса 1 литра раствора NaOН (р = 1,310г/мл) равна 1310г (1000 . 1,310 = 1310).
Массовую долю гидроксида натрия вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
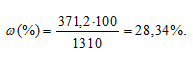
Ответ: 28,34%.
Задача 421.
Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1л 0,25 н. раствора?
Решение:
Определим молярную массу эквивалента H2SO4 из соотношения:

где
MЭ(В) — молярная масса эквивалента соли, г/моль; М(В) — молярная масса соли; n — коэффициент при атоме металла; A — валентность металла.
Отсюда
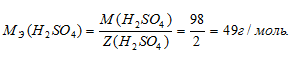
Рассчитаем массу H2SO4 в 1л 0,25н раствора по формуле:
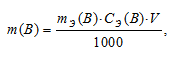
где
m(B) — масса вещества; mЭ(В) — молярная масса эквивалента вещества, г; СЭ(В) — эквива-лентная концентрация или нормальность; V — объём раствора.
Отсюда
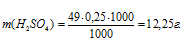
Теперь рассчитаем массу раствора, если известны массовая доля H2SO4 (96%) и масса H2SO4 (12,25г) по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
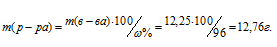
Определим объём раствора H2SO4, необходимого для приготовления 1л 0,25н раствора по формуле: m = pV, где p — плотность раствора, V — объём раствора.
Тогда
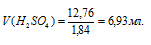
Ответ: 6,93 мл.
Задача 422.
Сколько миллилитров 0,5М раствора H2SO4 можно приготовить из 15 мл 2,5М раствора?
Решение:
Для нахождения массы серной кислоты, содержащейся в 15мл 2,5М раствора, можно определить по формуле:
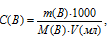
где
С(В) – молярная концентрация вещества (В), m(B) – масса растворённого вещества (В), М(В) – молярная масса вещества (В), V – объём раствора.
Тогда
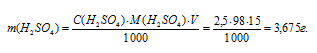
По этому же уравнению рассчитаем объём раствора, который можно приготовить из 3,675г H2SO4:
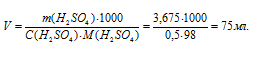
Ответ: 75мл.
Задача 423.
Какой объем 0,1М раствора H3PO4 можно приготовить из 75 мл 0,75н. раствора?
Решение:
Для решения задачи используем формулы:
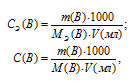
где
СЭ(В) – молярная концентрация эквивалента вещества (В);
С(В) — молярная концентрация вещества (В);
МЭ(В) – молярная масса эквивалента вещества (В);
M(B) — молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Определим молярную массу эквивалента H3PO4 из соотношения:
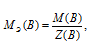
МЭ(В) — молярная масса эквивалента кислоты, г/моль; М(В) — молярная масса кислоты; Z(В) — эквивалентное число; Z(кислоты) равно числу ионов H+ в H3PO4 → 3.
Отсюда
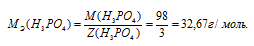
Рассчитаем массу ортофосфорной кислоты:
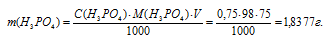
Определим объём раствора H3PO4, необходимого для приготовления раствора:
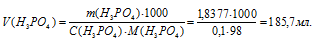
Ответ: 185,7мл.
Задача 424.
Какой объем 6,0М раствора НСI нужно взять для приготовления 25 мл 2,5М раствора НСI?
Решение:
Для нахождения массы соляной кислоты, содержащейся в 25 мл 2,5М раствора, а также объёма 6,0М раствора можно использовать формулу:
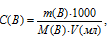
С(В) — молярная концентрация вещества (В);
M(B) — молярная масса вещества (В);
m(B) – масса растворённого вещества (В);
V(мл) – объём раствора.
Тогда
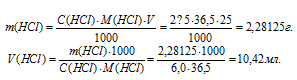
Ответ: 10,42мл.
Задача 425.
Плотность 40%-ного (по массе) раствора HNO3 равна 1,25г/мл. Рассчитать молярность и моляльность этого раствора.
Решение:
Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Массу HNO3, содержащуюся в 1 литре раствора, рассчитаем по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
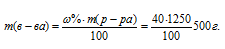
Молярную концентрацию раствора (CM) получим делением числа граммов HNO3 в 1л раствора на молярную массу HCl (36,5г/моль):
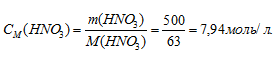
Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:
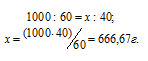
Теперь рассчитаем моляльность раствора:
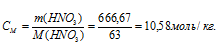
Ответ: 7,94 моль/л; 10б=,58 моль/л.
Задача 426.
Вычислить массовую долю гидроксида натрия в 9,28н. растворе NaOН (р = 1,310г/мл).
Решение:
Найдём массу NaOН, содержащуюся в 1000 мл раствора из пропорции:
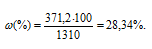
Масса 1 литра раствора NaOН (р = 1,310г/мл) равна 1310г (1000 . 1,310 = 1310).
Массовую долю гидроксида натрия вычислим по формуле:

где — массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
Тогда
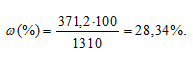
Ответ: 28,34%.
Эксперт
Группа: Супермодераторы
Сообщений: 6473
13.2.0. Плотность раствора серной кислоты с концентрацией 1,4 моль/л составляет 1,085 гр/см3. Определите массовую долю H2SO4 в этом растворе.
Возьмем литр раствора.
Масса растворенной кислоты составит
m = C*V*Mr = 1,4*1*98 = 137,2 г.
Масса раствора составит m(p-p) = ρ*V = 1,085*1000 = 1085 г.
ω = 100m/m(p-p) = 100*137,2/1085 = 12,6%.
13.2.1. Какое количество вещества (моль) и какая масса соли содержится в 250 мл. 0,4 М раствора карбоната натрия?
Заметим сразу, что размерность молярности — моль/л, поэтому объем надо перевести в литры.
250 мл. = 0,25 л.
n = См*V = 0,4*0,25 = 0,1 моль.
m = Cм*V*Mr(Na2CO3) = 0,4*0,25*106 = 10,6 г.
13.2.2. Какое количество вещества (моль) и какая масса соли содержится в 250 мл. 0,2 н. раствора карбоната натрия?
n = Cн*V*f = 0,2*0,25*(1/2) = 0,025 моль.
m = Cм*V*Mr(Na2CO3)*f = 0,2*0,25*106*(1/2) = 2,65 г.
13.2.3 Плотность раствора азотной кислоты с массовой долей HNO3 40% равна 1,25 г/мл. Вычислите молярность, нормальность и моляльность этого раствора.
Для простоты расчетов, возьмем литр этого раствора.
Определим массу одного литра.
m(р-р) = ρV = 1,25*1000 = 1250 граммов.
Определим массу кислоты.
m(HNO3) = 0,4*1250 = 500 г.
Масса воды составит 1250 — 500 = 750 г. = 0,75 кг.
Определим молярность.
См = m/(Mr*V) = 500/63*1 = 7,94 M.
Определим нормальность.
Сн = См/f = 7,94/1 = 7,94 н.
Определим моляльность.
Cm = n/m(растворитель) = (500/63) / 0,75 = 10,58 моль/кг.
13.2.4.Сколько граммов Na2B4O7*10H2O нужно для приготовления 100 мл 0,1М раствора?
Определим массу безводной соли.
m = CVMr = 0,1*0,1*201,2 = 2,012 г.
Определим массу кристаллогидрата.
m(к.г.) = m(Mr(Na2B4O7*10H2O)/Mr(Na2B4O7)) = 2,012(381,2/201,2) = 3,812 г.
13.2.5. Какова нормальность раствора карбоната натрия 0,5л которого содержится 0,075 г соли? (реакция полного замещения)
В реакции полного замещения для карбоната натрия f = 1/2.
Сн = m/Mr*V*f = 0,075/(106*0,5*(1/2)) = 0,00283 н.
13.2.5.1.
Имеется 5 кг раствора карбоната натрия с ω(Na2CO3) = 17.7% (p= 1.19 г/мл). Вычислите молярную концентрацию Na2CO3. Какой станет массовая доля Na2CO3 , если к этому раствору добавить 0,6 кг воды?
Для решения первой части задачи масса раствора не нужна, можно задаться любым количеством, т.к. концентрация будет одной и той же в любом его объеме. Можно взять просто литр. Но мы ее все-таки задействуем.
Объем раствора составит V = 5000/1,19 = 4201,68 мл. = 4,20168 л.
Масса соли составит m = 5000*17,7/100 = 885 г.
Определим молярность.
Cм = m/Mr*V = 885/106*4,20168 = 1,987 М.
Вторая часть. 0,6 кг = 600 г. Массу соли мы уже определили.
ω = 100*885/(5000 + 600) = 15,8%.
13.2.6. Смешаны 0,8 л. 1,5 н. NaOH и 0,4 л. 0,6 н. NaOH. Какова эквивалентная концентрация (нормальность) полученного раствора?
Определим количество вещества в каждом растворе.
n1 = C1 * V1 = 1,5 * 0,8 = 1,2 моль-экв.
n2 = C2 * V2 = 0,6 * 0,4 = 0,24 моль-экв.
Суммарно в полученном растворе будет
n = n1 + n2 = 1,2 + 0,24 = 1,44 моль-экв.
Определим объем.
V = V1 + V2 = 0,8 + 0,4 = 1,2 л
Определим нормальность.
С = n / V = 1,44 / 1,2 = 1,2 н.
13.2.7. Какой объем 0,2 н. раствора можно приготовить из 1 л. 0,6 н. раствора?
По закону эквивалентов (для раствора),
C1V1 = C2V2
Отсюда,
0,6*1 = 0,2*V
V = 3 литра.
13.2.8. Какой объем 0,1 н. раствора надо прилить к 100 мл. 1 н. рствора для получения 0,2 н. раствора?
По закону эквивалентов (для раствора),
C1V1 + C2V2 = C3V3
Для разбавленных растворов, V1 + V2 = V3
Отсюда,
0,1*V + 1*0,1 = 0,2(V + 0,1)
V = 0,8 л. = 800 мл.
13.2.9. Сколько мл 12%-ного раствора хлорида натрия (плотность 1,085 г/мл) нужно для приготовления 200 мл 0,5 н. раствора?
Определим массу соли.
m = C*V*Mr*f = 0,5*0,2*58,5*1 = 5,85 г.
Определим массу раствора.
m(p-p) = 100m/ω = 100*5,85/12 = 48,75 г.
Определим объем.
V = m/ρ = 48,75/1,085 = 44,93 мл.
13.2.10 Сколько граммов 50%го раствора Na2CO3 (ρ=1,3 г/мл) надо взять, чтобы приготовить 2 л раствора с (С=6 моль/л)? Какой это объем?
Определим массу соли. m = C*V*Mr = 6*2*106 = 1272 г.
Определим массу раствора. m(p-p) = 100m/ω = 100*1272/50 = 2544 г.
Определим объем. V = m/ρ = 2544/1,3 = 1956,92 мл.
Легко видеть, что объемы 6М и 50% раствора практически равны.
13.2.11
Смешали 400 г. 10%-го (по массе) раствора K2SO3 с 300 мл. 2М раствора этой же соли (плотность=1,12г/мл). Определить нормальность полученного раствора. (плотность =1,10 г/мл).
Масса соли в первом растворе составит
m = m(p-p)ω/100 = 400*0,1 = 40 г.
Масса соли во втором растворе составит
m = C*V*Mr = 2*0,3*158 = 94,8 г.
Масса второго раствора составит m = ρV = 1,12*300 = 336 г.
Масса полученного в результате смешивания раствора составит 400 + 336 = 736 г.
Его объем V = m/ρ = 736/1,1 = 669 мл.
Масса соли в нем будет 40 + 94,8 = 134,8 г.
Сн = m/Mr*V*f = 134,8/(158*0,669*(1/2)) = 2,55 н.
13.2.12
В каком объемном отношении необходимо смешать растворы соляной кислоты с молярной концентрацией 0,2 моль/дм3 и едкого натра с массовой долей 2,0 % и p=1,021 г/см3, чтобы получить нейтральный раствор соли? Какова будет молярная концентрация полученного раствора соли?
Определим молярность раствора щелочи.
См = 10ωρ/Mr = 10*2*1,021/40 = 0,5105 M.
Из закона эквивалентов, C1V1 = C2V2 откуда легко вывести, что V1/V2 = C1/C2
то есть, отношение объемов равно отношению концентраций.
Тогда, отношение объемов будет равно 0,5105/0,2 = 2,5525.
То есть, можно взять 1 л. р-ра щелочи и 2,5525 л. р-ра кислоты. Найдем молярность исходя из этих объемов.
Количество вещества соли составит n(NaCl) = n(HCl) = n(NaOH) = C*V = 0,2*2,5525 = 1*0,5105 = 0,5105 моль.
См = n/V = 0,5105/(1 + 2,5525) = 0,1437 M.
13.2.13
Определите массовую долю и молярную концентрацию раствора серной кислоты, полученного смешением 40 мл. 96% раствора плотностью 1,84г/мл, 30 мл. 40% раствора плотностью 1,5г/мл и 40 мл 4-молярного раствора серной кислоты 1,3 г/мл, если плотность конечного раствора=1,62 г/мл.
Определим массу раствора и массу кислоты в 40 мл. 96% раствора плотностью 1,84г/мл.
m(p-p) = Vρ = 40*1,84 = 73,6 г.
m(к-та) = m(p-p) ω/100 = 73,6*0,96 = 70,656 г.
Определим массу раствора и массу кислоты в 30 мл. 40% раствора плотностью 1,5г/мл.
m(p-p) = Vρ = 30*1,5 = 45 г.
m(к-та) = m(p-p) ω/100 = 45*0,4 = 18 г.
Определим массу раствора и массу кислоты в
40 мл 4-молярного раствора серной кислоты 1,3 г/мл.
m(p-p) = Vρ = 40*1,3 = 52 г.
m(к-та) = C*V*M = 4*0,04*98 = 15,68 г.
Определим массу полученного раствора.
m(p-p) = 73,6 + 45 + 52 = 170,6 г.
Определим массу кислоты в растворе.
m(к-та) = 70,656 + 18 + 15,68 = 104,336 г.
Определим объем раствора.
V = m/ρ = 170,6/1,62 = 105,3 мл. = 0,1053 л.
Определим массовую долю.
ω = 104,336/170,6 = 0,6116 (61,16%).
Определим молярную концентрацию.
См = m/Mr*V = 104,336/(0,1053*98) = 10,11 M.
Внимание! Для выражения одних концентраций через другие (перерасчета из одних концентраций в другие),
а также для проверки собственных расчетов можно воспользоваться on-line сервисом Пересчет концентраций растворов.
data-yashareType=»button» data-yashareQuickServices=»yaru,vkontakte,facebook,twitter,odnoklassniki,moimir,lj»
>
Поддержать проект
