Какая масса хлорида железа содержится в

Диляра Ш. · 11 ноября 2018
2,8 K
Педагог, музыкант, начинающий путешественник и немножко психолог
Реакция железа с хлором проходит следующим образом:
2Fe + 3Cl2 -> 2FeCl3
Рассчитаем количество вещества хлорида железа III по формуле:
n=m/M, где n — количество вещества, m — масса вещества, M — молярная масса вещества.
n(FeCl3) = 10,2/56+35,5*3 = 10,2/162,5 = 0,063 моль
Составим пропорцию:
х моль/2 моль -> 0,063 моль/2 моль
х=0,063 моль
m=n*M
m(Fe) = 0,063*56 =… Читать далее
Вычислить массу осадка образ при взаим 1,5 нитрата железа 3 с раствором гидроксида натрия?
Педагог, музыкант, начинающий путешественник и немножко психолог
У Вас отсутствует единица измерения количества нитрата железа III в условии задачи. Предположу, что имеются в виду граммы.
Реакция взаимодействия нитрата железа III с раствором гидроксида натрия выглядит следующим образом:
Fe(NO3)3 + 3NaOH -> Fe(OH)3 + 3NaNO3
По таблице растворимости определяем, что в осадок выпадет гидроксид железа III.
Рассчитаем количество вещества нитрата железа III по формуле:
n=m/M, где n — количество вещества, m — масса вещества, M — молярная масса вещества.
n(Fe(NO3)3) = 1,5/242 = 0,006 моль
Составим пропорцию:
0,01 моль/1 моль -> х моль/1 моль
х=0,006 моль
m=n*M
m(Fe(OH)3) = 0,006*107 = 0,66 г
Ответ: 0,66 г
Какова молекулярная масса оксида железа?
Книги, звери и еда — это хобби навсегда.
Молекулярная масса оксида железа зависит от валентности железа. Молекулярная масса оксида железа (II) FeO составляет M(FeO)=55.85+16=71.85 а.е.; молекулярная масса оксида железа (III) Fe2O3 составляет M(Fe2O3)=55.85*2+16*3=159.7 а.е.
Каким образом углерод добавляет прочности металлу? Как взаимодействует с железом? Именно на атомном уровне. И почему нельзя превышать определенный процент?
Researcher, Institute of Physics, University of Tartu
Углерод добавляет железу не столько прочность, сколько твердость. Пластичность при этом обычно снижается. Механизм двоякий:
1) образование карбида железа (цементит) и упорядоченных твердых растворов углерода в железе (аустенит, мартенсит, феррит и т.д.), обладающих высокой твердостью,
2) образование включений углерода в виде пластинок, хлопьев или глобул графита, которые тоже приводят к повышению твердости за счет создания напряжений в структуре.
В зависимости от содержания углерода и других легирующих добавок, а также от способа изготовления стали, ее фазовый состав и структура могут быть очень разными, соответственно, очень разными могут быть и механические характеристики. Писать подробно — это целый реферат получится. Почитайте про виды чугунов и сталей и про фазы и структуры железоуглеродистых сплавов, на эту тему есть куча литературы.
Вступает ли железо (твердое вещество) в реакцию с раствором хлорида меди (II) или нет? Преподаватель утверждает, что нет. Почему это так, не пойму.
Researcher, Institute of Physics, University of Tartu
Одним из первых опытов, который предлагается провести интересующимся химией школьникам у себя дома, это взять новый или предварительно оттертый от поверхностных загрязнений старый железный гвоздь и опустить его в достаточно концентрированный раствор медного купороса. При этом поверхность гвоздя покроется медью и приобретет характерный красноватый оттенок. Связано это с тем, что железо является более активным металлом, чем медь, и вытесняет ее из солей, то есть реакция:
Fe(0)тв. + Cu(2+)р-р -> Cu(0)тв. + Fe(3+)р-р (или 2+, но оно все равно быстро окисляется дальше)
является энергетически выгодной. Причин, по которым это не должно работать точно так же с хлоридом меди я не вижу. О-В потенциалы, конечно, будут немного другими, рН раствора другой, но я не думаю, что это критично. Что имеет в виду Ваш преподаватель я сказать не могу, единственно, что данная реакция кинетически очень затруднена и если железо не какое-то супер мелкодисперсное (т.н. «пирофорное» или что-то вроде того), то эта реакция не пройдет до конца, в смысле всё железо не растворится. Реакция будет остановлена образованием пленки меди на поверхности частиц/кусков железа.
Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % — го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % — го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % — го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С — ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С — ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С — ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон — ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 — ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль


 С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
 5 . С 3 = 2,2 моль/0,5л =4,4 М
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 — ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль


 ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р — ра = 146 г/0,38 = 384 г
m р — ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m

 воды = 150 г
воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С — ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С — ? 

 2. m в-ва = 1090 г ∙ 0,1 = 109 г
2. m в-ва = 1090 г ∙ 0,1 = 109 г

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ

 р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра — ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω

 р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 — ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V

 р-ра = 120 мл = 0,12 л
р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 — ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра — 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
 V р-ра 1 — ?
V р-ра 1 — ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 — ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
 7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
 m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра — ?
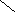
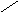 5. 15,7 % 10 м.ч
5. 15,7 % 10 м.ч
 10 %
10 %
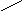

0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


 7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 — ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
 ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω  — ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
— ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
 4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 — ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
р-ра 1 — ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
 Ответ: 3,65 М
Ответ: 3,65 М 
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
 4. С = 6 моль / 1 л = 6 М
4. С = 6 моль / 1 л = 6 М
О твет: 6 М
твет: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
 4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 — ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
 8.С = 1,21 моль / 0, 0683 л = 17,7 М
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
