Какая функциональная группа придает аминокислоте кислые свойства

Среди
азотсодержащих органических веществ имеются соединения с двойственной функцией.
Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов
встречается около 300 различных аминокислот, но только 20 (α-аминокислоты) из них служат звеньями (мономерами), из которых построены пептиды и
белки всех организмов (поэтому их называют белковыми аминокислотами).
Последовательность расположения этих аминокислот в белках закодирована в
последовательности нуклеотидов соответствующих генов. Остальные аминокислоты
встречаются как в виде свободных молекул, так и в связанном виде. Многие из
аминокислот встречаются лишь в определенных организмах, а есть и такие, которые
обнаруживаются только в одном из великого множества описанных организмов.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты;
животные и человек не способны к образованию так называемых незаменимых
аминокислот, получаемых с пищей. Аминокислоты участвуют в обмене белков и
углеводов, в образовании важных для организмов соединений (например, пуриновых
и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот),
входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов,
антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче
нервных импульсов.
Аминокислоты — органические амфотерные соединения, в состав
которых входят карбоксильные группы – СООН и аминогруппы -NH2.
Аминокислоты можно рассматривать как
карбоновые кислоты, в молекулах которых атом водорода в радикале замещен
аминогруппой.
КЛАССИФИКАЦИЯ

Аминокислоты классифицируют по структурным признакам.
1.
В
зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты
подразделяют на α-, β-, γ-, δ-, ε- и
т. д.
2.
В
зависимости от количества функциональных групп различают кислые, нейтральные и
основные.
3.
По
характеру углеводородного радикала различают алифатические (жирные), ароматические,
серосодержащие и гетероциклические
аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
Примером
ароматической аминокислоты может служить пара-аминобензойная
кислота:
Примером
гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
НОМЕНКЛАТУРА
По систематической номенклатуре названия
аминокислот образуются из названий соответствующих кислот прибавлением
приставки амино- и указанием места расположения аминогруппы по отношению
к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:
Часто используется также другой способ
построения названий аминокислот, согласно которому к тривиальному названию
карбоновой кислоты добавляется приставка амино- с указанием положения
аминогруппы буквой греческого алфавита.
Пример:
Для α-аминокислот R-CH(NH2)COOH

, которые играют исключительно важную
роль в процессах жизнедеятельности животных и растений, применяются тривиальные
названия.
Таблица. Некоторые важнейшие α-аминокислоты
Аминокислота | Сокращённое обозначение | Строение радикала ( R ) |
Глицин | Gly (Гли) | H — |
Аланин | Ala (Ала) | CH3 — |
Валин | Val (Вал) | (CH3)2CH — |
Лейцин | Leu (Лей) | (CH3)2CH – CH2 — |
Серин | Ser (Сер) | OH- CH2 — |
Тирозин | Tyr (Тир) | HO – C6H4 – CH2 — |
Аспарагиновая кислота | Asp (Асп) | HOOC – CH2 — |
Глутаминовая кислота | Glu (Глу) | HOOC – CH2 – CH2 — |
Цистеин | Cys (Цис) | HS – CH2 — |
Аспарагин | Asn (Асн) | O = C – CH2 – │ NH2 |
Лизин | Lys (Лиз) | NH2 – CH2- CH2 – CH2 — |
Фенилаланин | Phen (Фен) | C6H5 – CH2 — |
Если
в молекуле аминокислоты содержится две аминогруппы, то в ее названии
используется приставка диамино-, три группы NH2 – триамино-
и т.д.
Пример:
Наличие
двух или трех карбоксильных групп отражается в названии суффиксом –диовая
или -триовая кислота:
ИЗОМЕРИЯ
1. Изомерия углеродного скелета
2. Изомерия положения функциональных
групп
3. Оптическая изомерия
α-аминокислоты, кроме глицина NН2-CH2-COOH.
ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты представляют собой
кристаллические вещества с высокими (выше 250°С) температурами плавления,
которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны.
Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в
воде и нерастворимы в органических растворителях, чем они похожи на
неорганические соединения. Многие аминокислоты обладают сладким вкусом.
ПОЛУЧЕНИЕ
3. Микробиологический синтез. Известны микроорганизмы, которые
в процессе жизнедеятельности продуцируют α — аминокислоты белков.
ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты
амфотерные органические соединения, для них характерны кислотно-основные
свойства.
I.Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные
растворы электропроводны. Эти свойства объясняются тем, что молекулы
аминокислот существуют в виде внутренних солей, которые образуются за счет
переноса протона от карбоксила к аминогруппе:
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую
или щелочную среду в зависимости от количества функциональных групп.
Видео-опыт «Свойства аминоуксусной кислоты»
2. Поликонденсация→ образуются полипептиды (белки):
При взаимодействии двух
α-аминокислот образуется дипептид.
3. Разложение → Амин +
Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы
(кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH
+ NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa — натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные
эфиры – летучие вещества (р.
этерификации): NH2-CH2-COOH
+ CH3OH HCl(газ)→ NH2-CH2-COOCH3
+ H2O
NH2-CH2-COOCH3 — метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются
амиды:
NH2-CH(R)-COOH + H-NH2 →
NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет
внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой
кислоты, в результате которого образуется ε-капролактам (полупродукт для
получения капрона):
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно
первичным аминам):
NH2-CH(R)-COOH +
HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение
объёма выделившегося азота позволяет определить количество аминокислоты (метод
Ван-Слайка)
IV.Качественная реакция
1. Все аминокислоты окисляются
нингидрином с образованием продуктов сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты
образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую
синюю окраску, используются для обнаружения α-аминокислот.
Видео-опыт «Образование медной соли аминоуксусной кислоты».
ПРИМЕНЕНИЕ
1) аминокислоты широко
распространены в природе;
2) молекулы аминокислот – это те
кирпичики, из которых построены все растительные и животные белки;
аминокислоты, необходимые для построения белков организма, человек и животные
получают в составе белков пищи;
3) аминокислоты прописываются при
сильном истощении, после тяжелых операций;
4) их используют для питания
больных;
5) аминокислоты необходимы в
качестве лечебного средства при некоторых болезнях (например, глутаминовая
кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты
применяются в сельском хозяйстве для подкормки животных, что положительно
влияет на их рост;
7) имеют техническое значение:
аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна –
капрон и энант.
О РОЛИ АМИНОКИСЛОТ
Нахождение в природе и биологическая роль аминокислот
Аминокислоты относятся к гетерофункциональным соединениям, т.е. вещества, проявляющим свойства двух классов соединений. В неорганической химии такие соединения называют амфотерными.
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений.
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. $alpha$-аминокислоты являются амфотерными электролитами. Имея как минимум две диссоциирующие и противоположно заряженные группировки, аминокислоты в растворах с нейтральным значением рН практически всегда находятся в виде биполярных ионов, или цвиттер-ионов, в которых противоположные заряды пространственно разделены, например $H_3^+N—CH_2—CH_2—COO^-$.
Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
1. Кислотные свойства аминокислот проявляются по карбоксильной группе в их способности взаимодействовать, например, с щелочами:

или вступать в реакцию этерификации со спиртами с образованием сложных эфиров:

2. Основные свойства аминокислот проявляются по аминогруппе в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:

3. Амфотерность аминокислот проявляется также в их способности образовывать в растворе в результате диссоциации биполярный ион — внутреннюю соль, а самое главное, за счет амфотерности аминокислоты могут вступать друг с другом в реакции поликонденсации. образуя полипептиды и белки:

КАЧЕСТВЕННЫЕ (ЦВЕТНЫЕ) РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ
Качественные цветные реакции можно подразделить на два типа: универсальные и специфические. К универсальным реакциям относятся те, которые дают окрашивание в присутствии любых белков.

Специфические реакции доказывают наличие какой-то определенной аминокислоты. Все качественные реакции можно наблюдать на примере раствора яичного белка, представляющего собой многокомпонентную смесь аминокислот:

УНИВЕРСАЛЬНЫЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Биуретовая реакция — универсальная реакция на все белки и пептиды, так как является реакцией на пептидную связь. Представляет собой взаимодействие щелочного раствора биурета ($(H_2NC(O))_2NH$ с раствором сульфата меди в присутствии гидроксида натрия (реактив Фелинга).

В реакцию, подобную биуретовой, вступают многие вещества, содержащие в молекуле не менее двух амидных группировок, амиды и имиды аминокислот и некоторые другие соединения. Продукты реакции в этом случае имеют фиолетовую или синюю окраску.


В условиях биуретовой реакции белки дают фиолетовую окраску, что используется для их качественного и количественного анализа. Биуретовая реакция обусловлена присутствием в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные солеобразные комплексы меди.
2. Нингидриновая реакция — цветная реакция на α-аминокислоты, которую осуществляют нагреванием последних в избытке щелочного раствора нингидрина (гидрата 1,2,3-индантриона).


Образующееся в результате реакции соединение (дикетогидринимин — на рисунке самый левый продукт реакции) имеет фиолетово-синюю окраску. Данную используют для колориметрического количественного определения $alpha$-аминокислот, в том числе в автоматических аминокислотных анализаторах.
СПЕЦИФИЧЕСКИЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Реакция Щульца-Распайли (аналогично проводится реакция Адамкевича, только с добавлением глиоксиловой кислоты) — является специфической реакцией на аминокислоту триптофан — взаимодействие раствора яичного белка с 10% раствором сахарозы и равным объемом концентрированной $H_2SO_4$. На границе двух жидкостей образуется красно-фиолетовое кольцо (при нагревании на водяной бане реакция идет быстрее — главное не смешивать жидкости).


2. Реакция Милона — используется для обнаружения тирозина, в составе которого имеется фенольный гидроксил. При добавлении к раствору белка реактива Милона (раствор $HgNO_3$ и $Hg(NO_3)_2$ в разбавленной азотной кислоты $HNO_3$, содержащей примесь азотистой кислоты $HNO_2$) образуется осадок, сначала окрашенный в розовый, а затем в пурпурно-красный цвет. Нагревание до $50^circ C$ ускоряет эту реакцию.


3. Ксантопротеиновая реакция — является специфической реакцией и используется для обнаружения $alpha$-аминокислот, содержащих в радикале ароматический цикл, например фенилаланина. Для ее осуществления к раствору белка прибавляют концентрированную азотную кислоту $HNO_3$ до тех пор, пока не прекратится образование осадка, который при нагревании окрашивается в желтый цвет. Окраска возникает в результате нитрования ароматических колец аминокислотных остатков белка (тирозина и триптофана). При добавлении к охлажденной жидкости избытка щелочи появляется оранжевое окрашивание, обусловленное образованием солей нитроновых кислот.



4. Реакция Фоля на серосодержащие аминокислоты (цистеин, метионин) — взаимодействие раствора яичного белка с 30% раствором NaOH и 5% раствором уксуснокислого свинца — $Pb(CH_3COO)_2$. При длительном нагревании жидкость буреет, выпадает черный осадок сульфида свинца.


Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
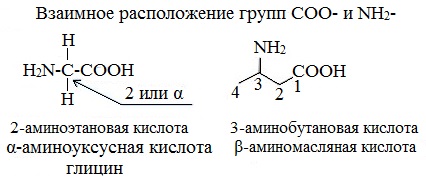
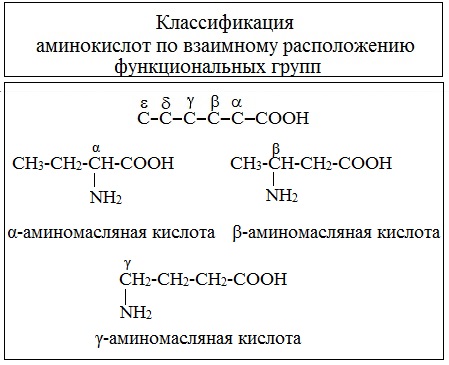
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
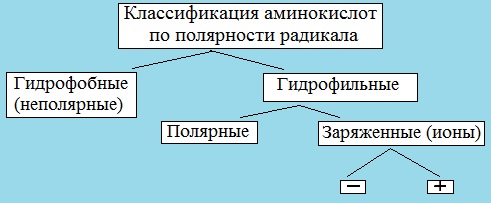
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
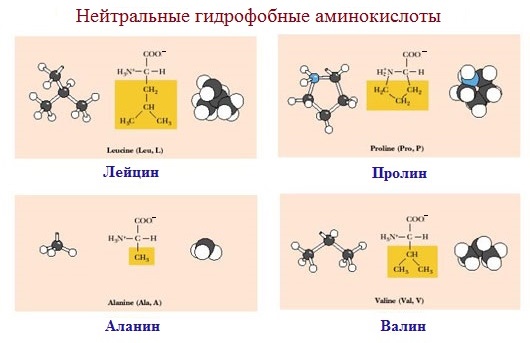
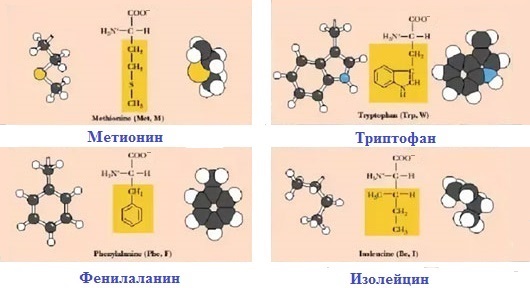
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
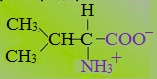
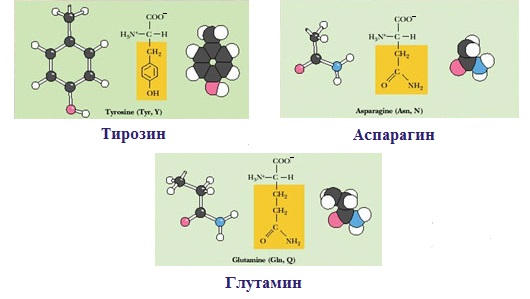
2. Полярные незаряженные
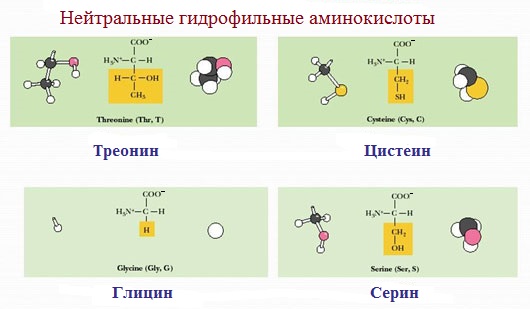
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
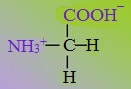
3. Заряженные отрицательно при рН-7 (кислые)
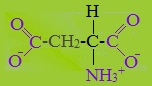
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.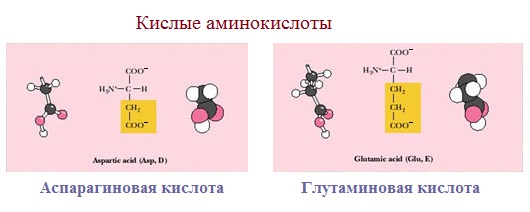
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.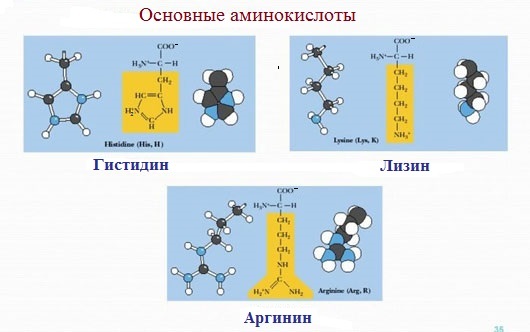
В ионизированном виде они имеют суммарный положительный заряд:
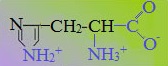
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
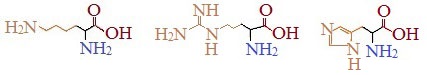
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
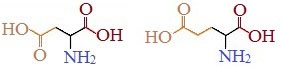
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
