Какая функциональная группа глюкозы проявляет восстанавливающие свойства

Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
Глюкоза
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
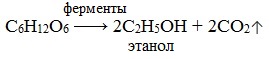
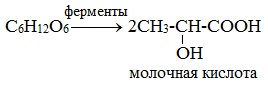
2) Молочнокислое брожение
 (образуется в организмах высших животных при мышечных сокращениях).
(образуется в организмах высших животных при мышечных сокращениях).
3) Маслянокислое брожение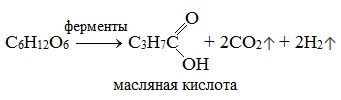
4) Лимоннокислое брожение
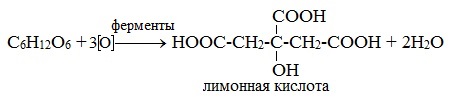
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
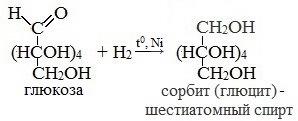
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
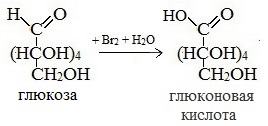
2. Окисление
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала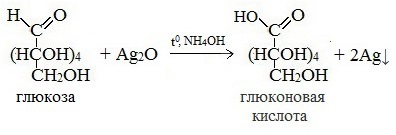
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
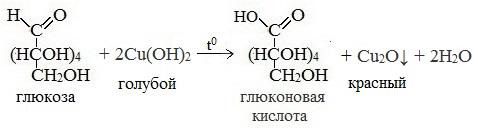
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
1. Взаимодействие с Cu (ОН)2с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
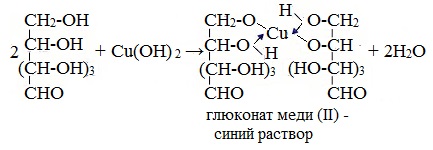
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
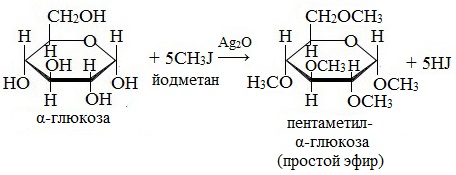
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты: 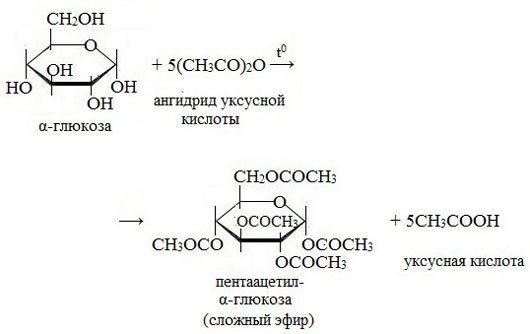
Реакции с участием полуацетального гидроксила
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
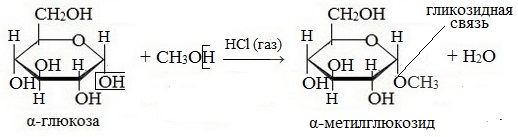
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
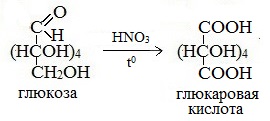
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Углеводы
Моносахариды
Получение глюкозы
В промышленности
Гидролизкрахмала:
(C6H10O5)n
+ nH2O t,H+→ nC6H12O6
крахмал глюкоза
В лаборатории
Из формальдегида
(1861 г
А.М. Бутлеров):
6 HCOH Ca(OH)2→ C6H12O6
формальдегид
В природе
Фотосинтез:
6CO2 + 6H2O
hν, хлорофилл → C6H12O6 +
6O2
Другие способы
Гидролиз дисахаридов:
C12H22O11 + H2O t,H+→ 2 C6H12O6
мальтоза
глюкоза
C12H22O11 + H2O t,H+→ C6H12O6
+ C6H12O6
сахароза глюкоза
фруктоза
Химические свойства глюкозы
I.
Специфические свойства
Важнейшим свойством моносахаридов
является их ферментативное брожение, т.е. распад молекул на осколки под
действием различных ферментов. Брожение происходит в присутствии ферментов,
выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В
зависимости от природы действующего фермента различают реакции следующих видов:
1.Спиртовое брожение:
C6H12O6 → 2C2H5-OH + 2CO2↑
2. Молочнокислое брожение:
3. Маслянокислоеброжение:
C6H12O6 → C3H7COOH
+ 2H2 ↑+ 2CO2↑
II. Свойства
альдегидов
1. Реакция серебряного зеркала:
Видео «Качественная реакция глюкозы саммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COH + Ag2O t.NH3→ СH2OH(CHOH)4-COOH + 2Ag↓
или
СH2OH(CHOH)4-COH + 2[Ag(NH3)2]OH → СH2OH(CHOH)4-COONH4 + 2Ag↓+ 3NH3 + H2O
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
СH2OH(CHOH)4-COH + 2Cu(OH)2t→ СH2OH(CHOH)4-COOH + Cu2O + 2H2O
голубой красный
3. Восстановление:
СH2OH(CHOH)4-COH
+ H2t,Ni → СH2OH(CHOH)4-CH2OH
сорбит – шестиатомный спирт
III. Свойствамногоатомныхспиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии
газообразного хлористого водорода атом водорода гликозидного гидроксила
замещается на метильную группу.
α — глюкоза | + СH3ОН | HCl(газ)→ | + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько
капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида
меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае
глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт,
образуя комплексное соединение – ярко синего цвета.
Видео
«Качественная реакция глюкозы с гидроксидом меди (II)»
(глюкозат меди (II) – синий раствор)
Применение
Глюкоза является ценным питательным
продуктом. В организме она подвергается сложным биохимическим превращениям в
результате которых образуется диоксид углерода и вода, при это выделяется
энергия согласно итоговому уравнению:
C6H12O6
+ 6O2 → 6H2O
+ 6CO2 + 2800 кДж
Так как глюкоза легко усваивается
организмом, её используют в медицине в качестве укрепляющего лечебного средства
при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и
противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле
(изготовление мармелада, карамели, пряников и т. д.), в текстильной
промышленности в качестве восстановителя, в качестве исходного продукта при
производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных
сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например,
при квашении капусты, огурцов, молока происходит молочнокислое брожение
глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса
недостаточно уплотнена, то под влиянием проникшего воздуха происходит
маслянокислое брожение и корм становится непригоден к применению. На практике
используется также спиртовое брожение глюкозы, например при производстве пива.
ВИДЕО:
Окислениеглюкозы кислородом воздуха в присутствии метеленового голубого
Определениеглюкозы в виноградном соке
Углеводы (сахара) – органические соединения, имеющие сходное строение, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4 (на один атом кислорода меньше, чем рибоза).
По числу структурных звеньев
- Моносахариды — содержат одно структурное звено.
- Олигосахариды — содержат от 2 до 10 структурных звеньев (дисахариды, трисахариды и др.).
- Полисахариды — содержат n структурных звеньев.
Некоторые важнейшие углеводы:
| Моносахариды | Дисахариды | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 | Сахароза С12Н22О11 Лактоза С12Н22О11 Мальтоза С12Н22О11 Целлобиоза С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал(С6Н10О5)n |
По числу атомов углерода в молекуле
- Пентозы — содержат 5 атомов углерода.
- Гексозы — содержат 6 атомов углерода.
- И т.д.
По размеру кольца в циклической форме молекулы
- Пиранозы — образуют шестичленное кольцо.
- Фуранозы — содержат пятичленное кольцо.
1. Горение
Все углеводы горят до углекислого газа и воды.
Например, при горении глюкозы образуются вода и углекислый газ
C6H12O6 + 6O2 → 6CO2 + 6H2O
2. Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода
C6H12O6 → 6C + 6H2O
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных.
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула | Глюкоза C6H12O6 | Фруктоза C6H12O6 | Рибоза C6H12O6 |
| Структурная формула |  |  |  |
| Классификация |
|
|
|
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.

Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:

Качественная реакция на многоатомные спирты: реакция со свежеосажденным гидроксидом меди (II)
При взаимодействии свежеосажденного гидроксида меди (II) с глюкозой (и другими моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
- Реакция «серебряного зеркала»

- Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):

- Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:

- Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи.
- Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:

- Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:

Маслянокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
![]()
- Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):

Простые эфиры глюкозы получили название гликозидов.
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы):

Получение глюкозы
Гидролиз крахмала
В присутствии кислот крахмал гидролизуется:
(C6H10O5)n + nH2O → nC6H12O6
Синтез из формальдегида
Реакция была впервые изучена А.М. Бутлеровым. Синтез проходит в присутствии гидроксида кальция:
6CH2=On → C6H12O6
Фотосинтез
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6H2O → C6H12O6 + 6O2
Фруктоза — структурный изомер глюкозы. Это кетоноспирт (кетоза): она тоже может существовать в циклических формах (фуранозы).
Она содержит шесть атомов углерода, одну кетоновую группу и пять гидроксогрупп.
Фруктоза – кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза.
В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы связаны с наличием кетонной и пяти гидроксильных групп.
При гидрировании фруктозы также получается сорбит.
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).
Сахароза (свекловичный или тростниковый сахар) С12Н22О11
Молекула сахарозы состоит из остатков α-глюкозы и β-фруктозы, соединенных друг с другом:

В молекуле сахарозы гликозидный атом углерода глюкозы связан из-за образования кислородного мостика с фруктозой, поэтому сахароза не образует открытую (альдегидную) форму.
Такие дисахариды называют невосстанавливающими, т.е. не способными окисляться.
Сахароза подвергается гидролизу подкисленной водой. При этом образуются глюкоза и фруктоза:
C12H22O11 + 6H2O → C6H12O6 + C6H12O6
глюкоза фруктоза
Мальтоза С12Н22О11
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.

Мальтоза является восстанавливающим дисахаридом (одно из циклических звеньев может раскрываться в альдегидную группу) и вступает в реакции, характерные для альдегидов.
При гидролизе мальтозы образуется глюкоза.
C12H22O11 + H2O → 2C6H12O6
Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала.
Полисахариды — это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы.
Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства.
Это объясняется особенностями их пространственного строения.
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы:

Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.

В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
- Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:

Запись полного гидролиза крахмала без промежуточных этапов:
![]()
- Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
- Качественная реакция на крахмал: синее окрашивание с раствором йода.
Целлюлоза
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.

Свойства целлюлозы
- Образование сложных эфиров с азотной и уксусной кислотами.
Нитрование целлюлозы.
Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании целлюлозы избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина:
![]()
Ацилирование целлюлозы.
При действии на целлюлозу уксусного ангидрида (упрощённо-уксусной кислоты) происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН.
Получается ацетат целлюлозы – ацетатное волокно.
![]()
- Гидролиз целлюлозы.
Целлюлоза, подобно крахмалу, в кислой среде может гидролизоваться, в результате тоже получается глюкоза. Но процесс идёт гораздо труднее.

Пройдут века, эпохи, годы,
К вам мы прикованы на век,
Без вас немыслим человек”.
Углеводы… А это те самые сладости, которые вы так любите, (фрукты, торты, конфеты, варенье, шоколад и т.д., особенно много углеводов содержит виноград). Углеводы жизненно важные вещества, которые необходимы каждому организму. Эти вещества расходуются, и человек должен постоянно пополнять их запасы. Понятно, что вещества, входящие в состав тканей организма, не похожие на те, которые он употребляет в пищу. Организм человека перерабатывает пищевые продукты и в процессе своей жизнедеятельности постоянно расходует энергию, которая, как мы знаем, выделяется при окислении в тканях организма, углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
Углеводами называют природные органические вещества, формула которых содержит в своем составе углерод и воду. Углеводы способны давать нашему организму энергию, необходимую для его полноценной жизнедеятельности. По своей химической структуре, углеводы делятся на простые и сложные.
- 1К простым углеводам относятся углеводы, содержащиеся в молоке; фруктах и сладостях – моно- и олигосахариды.
- 2Сложными же углеводами являются такие соединения как крахмал, гликоген и целлюлоза. Они содержатся в злаковых, кукурузе, картофеле и животных клетках.
Продукты богатые углеводами:
Указано ориентировочное количество в 100 г продукта
Сахар-рафинад
99,9 г
Мармелад
79,4 г
Пряники
77,7 г
Соломка сладкая
69,3 г
Повидло яблочноеГречка60,4г
60,4 г
65 г
Овсяные хлопья «Геркулес»
61,8 г
Пшеничная мука
61,5 г
Итак, Глюкоза С6Н12О6 – моносахарид, не гидролизующийся с образованием более
простых углеводов.
Как видно из структурной формулы, глюкоза является одновременно многоатомным
спиртом и альдегидом, то есть альдегидоспиртом. В водных растворах глюкоза
может принимать циклическую форму.
Физические свойства
Глюкоза – бесцветное кристаллическое вещество со сладким вкусом, хорошо
растворимое в воде. По сравнению со свекловичным сахаром менее сладкая.
1) она встречается почти во всех органах растения: в плодах, корнях, листьях, цветах;
2) особенно много глюкозы в соке винограда и спелых фруктах, ягодах;
3) глюкоза есть в животных организмах;
4) в крови человека ее содержится примерно 0,1 %.
Особенности строения глюкозы:
1. Состав глюкозы выражается формулой: С6Н12O6, она принадлежит к
многоатомным спиртам.
2. Если раствор этого вещества прилить к свежеосажденному гидроксиду меди (II),
образуется ярко-синий раствор, как в случае глицерина.
Опыт подтверждает принадлежность глюкозы к многоатомным спиртам.
3. Существует сложный эфир глюкозы, в молекуле которого пять остатков уксусной
кислоты.
Из этого следует, что в молекуле углевода пять
гидроксильных групп.
Этот факт объясняет, почему глюкоза хорошо
растворяется в воде и имеет сладкий вкус.
Если раствор глюкозы нагреть с аммиачным раствором оксида серебра (I), то
получится характерное «серебряное зеркало».
Шестой атом кислорода в молекуле вещества входит в состав альдегидной группы.
4. Чтобы составить полное представление о строении глюкозы, надо знать, как
построен скелет молекулы. Поскольку все шесть атомов кислорода входят в состав
функциональных групп, следовательно, атомы углерода, образующие скелет,
соединены друг с другом непосредственно.
5. Цепь атомов углерода прямая, а не разветвленная.
6. Альдегидная группа может находиться только в конце неразветвленной углеродной
цепи, и гидроксильные группы могут быть устойчивы, находясь лишь у разных
атомов углерода.
Химические свойства
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1. Глюкоза – многоатомный спирт.
Глюкоза с Cu(OH)2 даёт раствор синего цвета (глюконат меди)
2. Глюкоза – альдегид.
а) Реагирует с аммиачным раствором оксидом серебра с образованием серебряного зеркала:
СН2ОН-(СНОН)4-СНО+Ag2O → СН2ОН-(СНОН)4-СОOH + 2Ag
глюконовая кислота
б) С гидроксидом меди даёт красный осадок Cu2O
СН2ОН-(СНОН)4-СНО + 2Cu(OH)2 → СН2ОН-(СНОН)4-СОOH + Cu2O↓ + 2H2O
глюконовая кислота
в) Восстанавливается водородом с образованием шестиатомного спирта (сорбита)
СН2ОН-(СНОН)4-СНО + H2 → СН2ОН-(СНОН)4-СH2OH

3. Брожение
а) Спиртовое брожение (для получения спиртных напитков)
С6H12O6 → 2СH3 –CH2OH + 2CO2 ↑
этиловый спирт
б) Молочнокислое брожение (скисание молока, квашение овощей)
C6H12O6 → 2CH3 –CHOH–COOH
молочная кислота
Применение, значение
Глюкоза образуется в растениях в процессе фотосинтеза. Животные получают её с
пищей. Глюкоза – главный источник энергии в живых организмах. Глюкоза является
ценным питательным продуктом. Применяется в кондитерском деле, в медицине как
укрепляющее средство, для получения спирта, витамина С и др.
