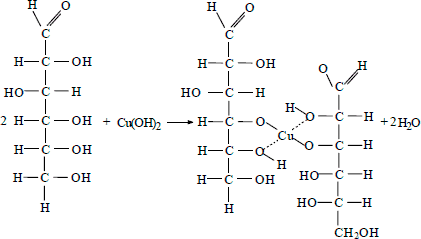Как опытным путем определить в каких пробирках содержатся растворы

В выданных вам трёх пробирках (варианты 1, 2 или 3) содержатся твёрдые вещества, а в трёх других (вариант 4) – растворы веществ.
Вариант 1
а) гидроксид натрия;
б) карбонат калия;
в) хлорид бария.
Вариант 2
а) карбонат кальция;
б) сульфат натрия;
в) хлорид калия.
Вариант 3
а) нитрат бария;
б) сульфат натрия;
в) карбонат кальция.
Вариант 4
а) хлорид натрия;
б) хлорид алюминия;
в) хлорид железа (III).
Опытным путём определите, в какой пробирке находится каждое из выданных вам веществ. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
После этой части работы выполните одну-две экспериментальные задачи из следующего перечня (по указанию учителя).
Задача 1
Докажите опытным путём, что железный купорос, образец которого вам выдан, содержит примесь сульфата железа (III). Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Задача 2
Получите оксид железа (III), исходя из хлорида железа (III). Напишите уравнения соответствующих реакций, а уравнение реакции с участием электролита и в ионном виде.
Задача 3
Получите раствор алюмината натрия, исходя из хлорида алюминия. Запишите уравнения проделанных реакций в молекулярном и ионном виде.
Задача 4
Получите сульфат железа (II), исходя из железа. Запишите уравнения проделанных реакций и разберите окислительно-восстановительные процессы.
Ответ
Вариант 1
Доказать содержимое пробирок можно с помощью раствора серной кислоты. Для этого прильём немного воды в пробирки с сухими веществами, и растворим их содержимое, а потом в каждую прильём раствор кислоты.
а) Видимых изменений нет:
2NaOH + H2SO4 ⟶ Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ + SO42- ⟶ 2Na+ + SO42- + 2H2O
2Na+ + SO42- ⟶ H2O
б) Выделится газ:
K2CO3 + H2SO4 ⟶ K2SO4 + H2O + CO2↑
2K+ + CO32- + 2H+ + SO42- ⟶ 2K+ + SO42- + H2O + CO2↑
2H+ + CO32- ⟶ H2O + CO2↑
в) Выпадет белый осадок:
BaCl2 + H2SO4 ⟶ 2HCl + BaSO4↓
Ba2+ + 2Cl- + 2H+ + SO42- ⟶ 2H+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
Вариант 2
Прильём немного воды в пробирки с сухими веществами, и перемешаем их содержимое.
а) Содержимое пробирки не растворилось, а после добавления раствора кислоты выделится газ:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
В пробирки, в которых произошло растворение веществ, добавим хлорида бария.
б) Выпал белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- ⟶ 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
в) Видимых изменений нет:
KCl + BaCl2 ⇸
Вариант 3
Прильём немного воды в пробирки с сухими веществами, и перемешаем их содержимое. В пробирки, где произошло растворение веществ, прильём раствор хлорида бария.
а) Содержимое пробирки растворилось, при добавлении хлорида бария изменений нет:
Ba(NO3)2 + BaCl2 ⇸
б) Содержимое пробирки растворилось, при добавлении хлорида бария выпал белый осадок:
Na2SO4 + BaCl2 ⟶ 2NaCl + BaSO4↓
2Na+ + SO42- + Ba2+ + 2Cl- ⟶ 2Na+ + 2Cl- + BaSO4↓
Ba2+ + SO42- ⟶ BaSO4↓
в) Содержимое пробирки не растворилось, после добавления раствора кислоты выделился газ:
CaCO3 + 2HCl ⟶ CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- ⟶ Ca2+ + 2Cl- + H2O + CO2↑
CaCO3 + 2H+ ⟶ Ca2+ + H2O + CO2↑
Вариант 4
Доказать содержимое пробирок можно с помощью раствора щелочи. Для этого прильём немного воды в пробирки с сухими веществами, и растворим их содержимое, а потом в каждую прильём щелочь.
а) Изменений не наблюдается.
NaCl + NaOH ⇸
б) Выпал белый осадок:
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓
Al3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Al(OH)3↓
Al3+ + 3OH- ⟶ Al(OH)3↓
в) Выпал бурый осадок:
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Fe(OH)3↓
Fe3+ + 3OH- ⟶ Fe(OH)3↓
Задача 1
Доказать, что железный купорос содержит примесь сульфата железа (III), можно с помощью качественной реакции на ионы Fe3+, для этого используем желтую кровяную соль, в результате реакции выпадет синий осадок:
2Fe2(SO4)3 + 3K4[Fe(CN)6] ⟶ 6K2SO4 + Fe4[Fe(CN)6]3↓
4Fe3+ + 6SO42- + 12K+ + 3[Fe(CN)6]4- ⟶ 12K+ + 6SO42- + Fe4[Fe(CN)6]3↓
4Fe3+ + 3[Fe(CN)6]4- ⟶ Fe4[Fe(CN)6]3↓
Задача 2
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Fe3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Fe(OH)3↓
Fe3+ + 3OH- ⟶ Fe(OH)3↓
2Fe(OH)3 t ⟶ Fe2O3 + 3H2O
Задача 3
AlCl3 + 3NaOH ⟶ 3NaCl + Al(OH)3↓
Al3+ + 3Cl- + 3Na+ + 3OH- ⟶ 3Na+ + 3Cl- + Al(OH)3↓
Al3+ + 3OH- ⟶ Al(OH)3↓
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
Al(OH)3 + Na+ + OH- ⟶ Na+ + [Al(OH)4]-
Al(OH)3 + OH- ⟶ [Al(OH)4]-
Задача 4
| CuSO4 + Fe ⟶ FeSO4 + Cu | ||
| Cu+2 + 2ē ⟶ Cu0 | 1 | окислитель (восстановление) |
| Fe0 — 2ē ⟶ Fe+2 | 1 | восстановитель (окисление) |
Задача 1
Вариант I. В двух склянках без этикеток находятся порошки: в одной – оксид кальция, в другой – оксид меди (II).
Как различить эти вещества, не проводя химических опытов?
Как химическими опытами подтвердить наличие в склянках именно этих веществ?
Вариант II. В двух склянках без этикеток находятся растворы: в одной – раствор соляной кислоты, в другой – гидроксида калия.
Как опытным путём определить, в какой склянке находится каждое из веществ?
Задача 2
Вариант I. Очистите химическим способом железный гвоздь от ржавчины, считая, что в состав ржавчины входят оксид железа (III)
и гидроксид железа (III).
Вариант II. Химическим способом отмойте пробирку, загрязнённую на практическом занятии гидроксидом меди (II).
Задача 3
Вариант I. После практической работы остался розовый раствор. Лаборант предполагает, что это раствор лакмуса в кислой среде. Проведите несколько опытов для проверки этого предположения.
Вариант II. В склянке без этикетки находится бесцветный раствор. Предполагают, что это раствор фенолфталеина. Проведите опыт, подтверждающий или опровергающий это предположение.
Мотивированный ответ и результаты опытов запишите в произвольной форме.
Задача 4
Вариант I. Из имеющихся на столе реактивов получите несколькими способами сульфат меди (II).
Вариант II. В вашем распоряжении есть магний, оксид магния, гидроксид магния, соляная кислота. Сколькими способами вы сможете получить хлорид магния, используя эти реактивы? Подберите необходимое для эксперимента оборудование и получите хлорид магния.
Задача 5
Вариант I. Получите опытным путём из хлорида железа (III) оксид железа (III).
Вариант II. Проведя два опыта, получите из хлорида меди (II) оксид меди (II).
Ответ
Задача 1
Различить оксид кальция от оксида меди (II) можно по цвету, оксид кальция – белый, а оксид меди (II) – черный.
Оксид кальция реагирует с водой, в большом количестве воды он растворяется:
CaO + H2O ⟶ Ca(OH)2
Если пропустить через образовавшийся раствор выдыхаемый воздух, то раствор помутнеет:
Ca(OH)2 + CO2 ⟶ CaCO3 + H2O
А оксид меди (II) не реагирует с водой, но реагирует с раствором серной кислоты, в результате реакции раствор окрашивается в синий цвет:
CuO + H2SO4 ⟶ CuSO4 + H2O
Задача 2
Очистить гвоздь можно с помощью соляной кислоты:
Fe2O3 + 6HCl ⟶ 2FeCl3 + 3H2O
Fe(OH)3 + 3HCl ⟶ FeCl3 + 3H2O
Задача 3
Добавим к раствору карбонат кальция, если в пробирке кислота, то должен выделяться углекислый газ, и по окончании реакции лакмус приобретёт фиолетовый цвет.
Задача 5
Для этого, сначала, получим гидроксид железа (III):
FeCl3 + 3NaOH ⟶ 3NaCl + Fe(OH)3↓
Для получения оксид железа (III) прокалим образовавшийся осадок:
2Fe(OH)3 t ⟶ Fe2O3 + 3H2O
Вариант II
Задача 1
Определить где находится гидроксид калия, а где соляная кислота можно с помощью лакмуса, в гидроксида калия он приобретет синий цвет, а в растворе кислоты – красный.
Задача 2
Чтобы отмыть пробирку от гидроксида меди (II), необходимо прилить соляную кислоту:
Cu(OH)2 + 2HCl ⟶ CuCl2 + 2H2O
Задача 3
Добавим к раствору щелочь, если в пробирке фенолфталеин, то он приобретёт малиновый цвет.
Задача 4
Хлорид магния можно получить тремя способами:
Mg + 2HCl ⟶ MgCl2 + H2↑
MgO + 2HCl ⟶ MgCl2 + H2O
Mg(OH)2 + 2HCl ⟶ MgCl2 + 2H2O
Задача 5
CuCl2 + 2NaOH ⟶ 2NaCl + Cu(OH)2
Cu(OH)2 t ⟶ CuO + H2O
1. В двух пробирках даны вещества: а) этанол; б) глицерин. Проведите опыты, подтверждающие их характерные свойства. Составьте уравнения соответствующих реакций.
2. В двух пробирках даны вещества: а) глюкоза; б) сахароза. Определите эти вещества при помощи характерных химических реакций и приведите соответствующие уравнения реакций.
3. Из этилового спирта получите сложный эфир. Составьте уравнения соответствующих реакций.
4. Даны две пробирки: одна с муравьиной кислотой, другая с уксусной. Определите химическим способом, где находится муравьиная кислота.
5. Докажите опытным путём, что картофель и белый хлеб содержат крахмал.
6. Определите с помощью характерных реакций каждое из трех предложенных веществ: крахмал, сахар и глюкозу.
7. Выданы пробирки с растворами альдегида и глюкозы. При помощи одних и тех же реактивов определите каждое вещество.
Ответ
1
а)
Этанол можно определить с помощью накалённой медной спирали, покрытой чёрным оксидом меди (II), если её опустить в этанол, то спираль становится блестящей:
| CH3–CH2–OH | + | CuO | t ⟶ |  | + | Cu | + | H2O |
б)
Раствор глицерина можно обнаружить с помощью свежеприготовленного гидроксида меди (II), при его нагревании с раствором глицерина в щелочной среде будет наблюдаться растворение осадка и окрашивание раствора в синий цвет:
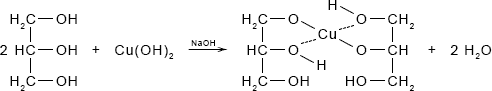
2
а)
Раствор глюкозы можно обнаружить реакцией с гидроксидом меди (II) при нагревании. Наблюдается изменение цвета гидроксида меди (II), в начале появляется жёлтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I):

б)
Раствор сахарозы можно обнаружить реакцией с гидроксидом меди (II) при нагревании. Наблюдается растворение гидроксида меди (II), и окрашивание раствора в синий цвет.
3
4
В молекуле муравьиной кислоты кроме карбоксильной группы можно выделить и альдегидную группу, которая придаёт данной кислоте восстановительные свойства, поэтому для неё характерна реакция серебряного зеркала:
`HCOOH + underset(«аммиачный р-р»)(Ag_2O) overset(t)(⟶) H_2O + CO_2 + 2Ag»↓»`
5
Крахмал можно обнаружить с помощью иода, при их взаимодействии появляется синее окрашивание. Капнув на картофель и белый хлеб раствором иода, появилось синее окрашивание, это доказывает то, что картофель и белый хлеб содержат крахмал.
6
Крахмал можно обнаружить с помощью иода, при взаимодействии крахмала с иодом появляется синее окрашивание.
Глюкозу можно обнаружить реакцией «серебряного зеркала»:
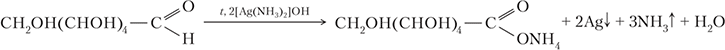
В пробирке, в которой изменений не произошло находится сахар.
7
Растворы альдегида и глюкозы можно различить с помощью свежеприготовленного гидроксида меди (II).
При взаимодействии раствора альдегида (метаналя) с гидроксидом меди (II) в щелочной среде, наблюдается изменение цвета гидроксида меди (II), в начале появляется жёлтый осадок гидроксида меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I):
При взаимодействии раствора глюкозы с гидроксидом меди (II) в щелочной среде, наблюдается окрашивание раствора в синий цвет: