Как определить у какого вещества кислотные свойства выражены сильнее

Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов.
4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая
говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы
увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.

В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг
атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны
«вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть
то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы,
то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена
конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.

Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех
веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера
обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную
линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются,
вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных
кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще
запомнить 😉

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны).
Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает
к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий
расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе
выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на
себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды,
ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру,
для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим,
что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене.
Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО.
Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.

Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко
найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Кислотными свойствами называют те, которые наиболее сильно проявляются в данной среде. Их существует целый ряд. Необходимо уметь определять кислотные свойства спиртов и других соединений не только для выявления содержания в них соответствующей среды. Это также важно для распознавания изучаемого вещества.

Существует множество тестов на наличие кислотных свойств. Наиболее элементарный — погружение в вещество индикатора — лакмусовой бумаги, которая реагирует на содержание водорода, розовея или краснея. Причем более насыщенный цвет демонстрирует более сильную кислоту. И наоборот.
Кислотные свойства усиливаются вместе с увеличением радиусов отрицательных ионов и, следовательно, атома. Это обеспечивает более легкое отщепление частиц водорода. Это качество является характерным признаком сильных кислот.
Существуют наиболее характерные кислотные свойства. К ним относятся:
— диссоциация (отщепление катиона водорода);
— разложение (образование кислотного оксида и воды под воздействием температуры и кислорода);
— взаимодействие с гидроксидами (в результате которого образуются вода и соль);
— взаимодействие с оксидами (в результате также образуются соль и вода);
— взаимодействие с металлами, предшествующими водороду в ряду активности (образуется соль и вода, иногда с выделением газа);
— взаимодействие с солями (только в том случае, если кислота сильнее той, которой образована соль).

Часто химикам приходится самостоятельно получать кислоты. Для их выведения существует два способа. Один из них — смешение кислотного оксида с водой. Этот способ используется наиболее часто. А второй — взаимодействие сильной кислоты с солью более слабой. Его используют несколько реже.
Известно, что кислотные свойства проявляются и у многих органических веществ. Они могут быть выражены сильнее или слабее в зависимости от строения ядер атомов. К примеру, кислотные свойства спиртов проявляются в способности отщеплять катион водорода при взаимодействии с щелочами и металлами.
Алкоголяты — соли спиртов — способны гидролизоваться под действием воды и выделять спирт с гидроксидом металла. Это доказывает, что кислотные свойства этих веществ слабее, чем у воды. Следовательно, среда выражена в них сильнее.
Кислотные свойства фенола гораздо сильнее в связи с повышенной полярностью ОН-соединения. Поэтому данное вещество может реагировать также с гидроксидами щелочноземельных и щелочных металлов. В результате образуются соли — феноляты. Чтобы выявить фенол, наиболее эффективно использовать качественную реакцию с хлоридом железа (III), в которой вещество приобретает сине-фиолетовую окраску.

Итак, кислотные свойства в различных соединениях проявляются одинаково, но с разной интенсивностью, что зависит от строения ядер и полярности водородных связей. Они помогают определять среду вещества и его состав. Наряду с данными свойствами, существуют также и основные, которые усиливаются с ослаблением первых.
Все эти характеристики проявляются в большинстве сложных веществ и составляют важную часть окружающего нас мира. Ведь именно за их счет проходят многие процессы не только в природе, но и в живых организмов. Поэтому кислотные свойства крайне важны, без них была бы невозможна жизнь на земле.
Органические
кислоты
В органических
соединениях в зависимости от природы
элемента, с которым связан Н+,
различают следующие кислоты:
ОН
– кислоты (карбоновые кислоты, фенолы,
спирты)
СН – кислоты
(углеводороды и их производные)
NH
– кислоты
(амины, амиды, имиды)
SH
– кислоты
(тиолы).
Кислотным центром
называется элемент и связанный с ним
атом водорода.
Сила кислоты будет
зависеть от стабильности
аниона, т.е.
от сопряженного основания, которое
образуется при отрыве Н+
от молекулы. Чем
стабильнее анион, тем выше кислотность
данного соединения.
Стабильность
аниона зависит от ряда факторов, которые
способствуют делокализации заряда. Чем
выше делокализация заряда, тем устойчивее
анион, тем сильнее кислотные свойства.
Факторы, оказывающие
влияние на степень делокализации:
Природа гетероатома
в кислотном центреЭлектронные
эффекты атомов углеводородных радикалов
и их заместителейСпособность
анионов к сольватации.
Зависимость
кислотности от гетероатома.
Под природой
гетероатома понимают его электроотрицательность
(Э.О.) и поляризуемость. Чем больше (Э.О.)
тем легче осуществляется гетеролитический
разрыв в молекуле. В периодах слева
направо с ростом заряда ядра растет
(Э.О), т.е. способность элементов удерживать
отрицательный заряд. В результате
смещения электронной плотности связь
между атомами поляризуется. Чем больше
электронов и чем больше радиус атома,
тем дальше электроны внешнего
энергетического уровня расположены от
ядра, тем выше поляризуемость и выше
кислотность.
Пример: СН-
NH- OH- SH-

увеличение
Э.О. и кислотности
С, N,О
– элементы одного периода. Э.О. по периоду
растет, кислотность увеличивается. В
этом случае поляризуемость влиять на
кислотность не будет.
Поляризуемость
атомов в периоде изменяется незначительно,
поэтому главным фактором определяющим
кислотность является Э.О.
Теперь рассмотрим
ОН- SH-

увел-е
кислотности
О, S
– находятся в одной группе, радиус в
группе сверху вниз увеличивается,
следовательно растет и поляризуемость
атома, что ведет к увеличению кислотности.
У S
радиус атома больше, чем у О, поэтому
тиолы проявляют более сильные кислотные
свойства по сравнению со спиртами.
Сравнить три
соединения: этанол, этантиол и аминоаэтанол:
Н3С
– СН2
– ОН,
Н3С
– СН2
– SH
и Н3С
– СН2
– NH2
Сравним по радикалу
– они одинаковые;По природе
гетероатома в функциональной группе:
S
и О находятся в одной группе, но у S
радиус атома больше, поляризуемость
выше, следовательно этантиол обладает
более сильными кислотными свойствамиТеперь сравним О
и N.
О обладает более высокой Э.О. , следовательно
кислотность у спиртов будет выше.
Влияние
углеводородного радикала и присутствующих
в нем заместителей
Необходимо обратить
внимание студентов, что сравниваемые
соединения должны иметь одинаковый
кислотный центр и один растворитель.
Электроноакцепторные
(Э.А.) заместители
способствуют делокализации электронной
плотности, что ведёт к стабильности
аниона и соответственно увеличению
кислотности.
Электронодонорные
(Э.Д.) заместители наоборот
способствуют концентрации электронной
плотности в кислотном центре, что ведет
к понижению кислотности и увеличению
основности.
Например: одноатомные
спирты проявляют более слабые кислотные
свойства по сравнению с фенолами.
Пример: Н3С
→ СН2
→ ОН 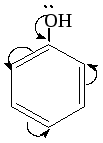
Кислотный центр
один и тот жеРастворитель
один и тот же
В одноатомных
спиртах электронная плотность смещается
от углеводородного радикала к группе
ОН, т.е. радикал проявляет +I
эффект, тогда на группе ОН сосредотачивается
большое количество электронной плотности
в результате чего Н+
более прочно
связан с О и разрыв связи О-Н происходит
трудно, поэтому одноатомные спирты
проявляют слабые кислотные свойства.
У фенола наоборот
бензольное кольцо является Э.А., а группа
ОН-
— Э.Д.
За счет того, что
гидроксильная группа входит в общее
р-π сопряжение с бензольным кольцом, в
молекуле фенола происходит делокализация
электронной плотности и кислотность
увеличивается, т.к. сопряжение всегда
сопровождается усилением кислотных
свойств.
Увеличение
углеводородного радикала в монокарбоновых
кислотах также влияет на изменение
кислотных свойств и при введении
заместителей в углеводородный происходит
изменение кислотных свойств.
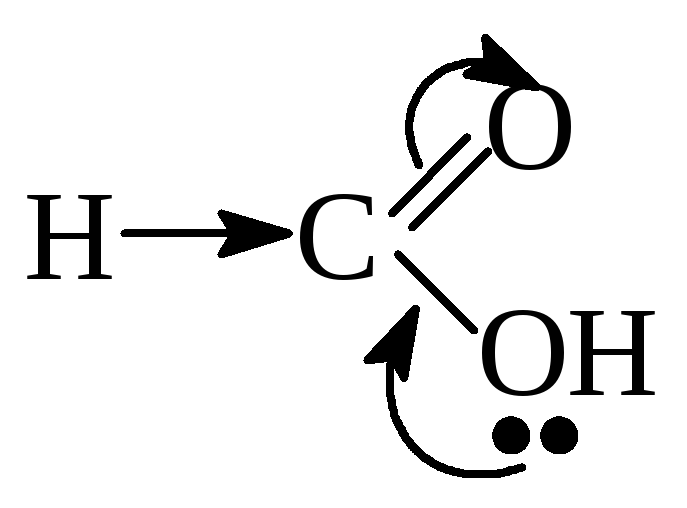
Пример:
в карбоновых кислотах при диссоциации
образуются карбоксилат-ионы – самые
стабильные органические анионы.
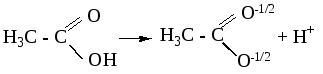
В карбоксилат-ионе
отрицательный заряд за счет р, π-сопряжения
распределён поровну между двумя атомами
кислорода, т.е. он делокализован и
соответственно менее концентрирован,
поэтому в карбоновых кислотах кислотный
центр более сильный, чем в спиртах и
фенолах.
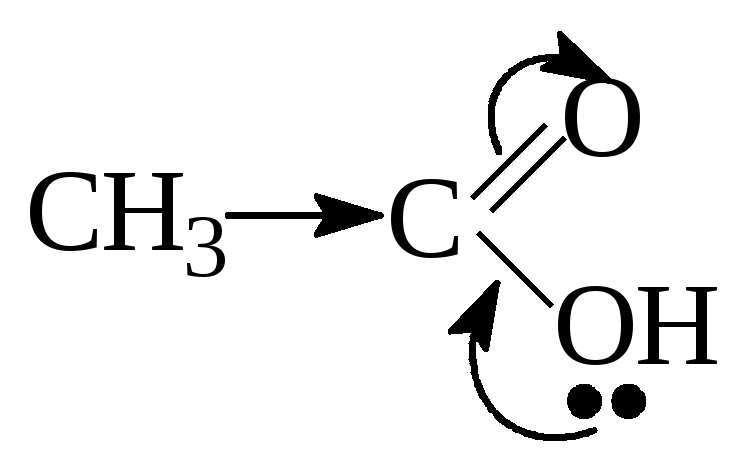
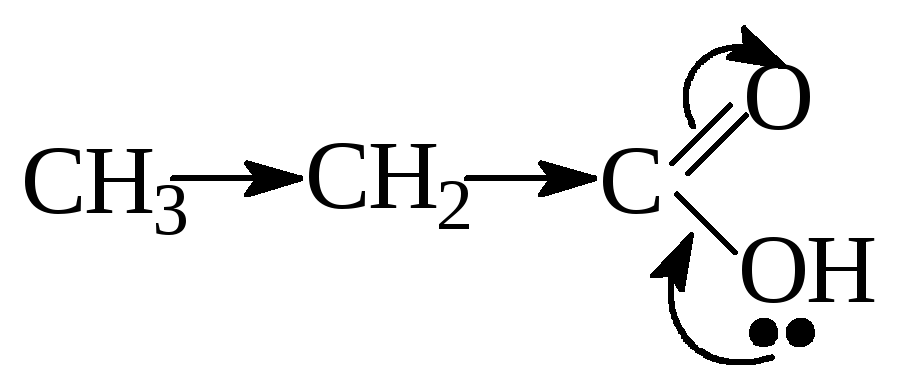
С увеличением
углеводородного радикала, который
выполняет роль Э.Д. кислотность
монокарбоновых кислот снижается за
счет уменьшения δ+
на атоме углерода карбоксильной группы.
Поэтому в гомологическом ряду кислот
самой сильной является муравьиная
кислота.
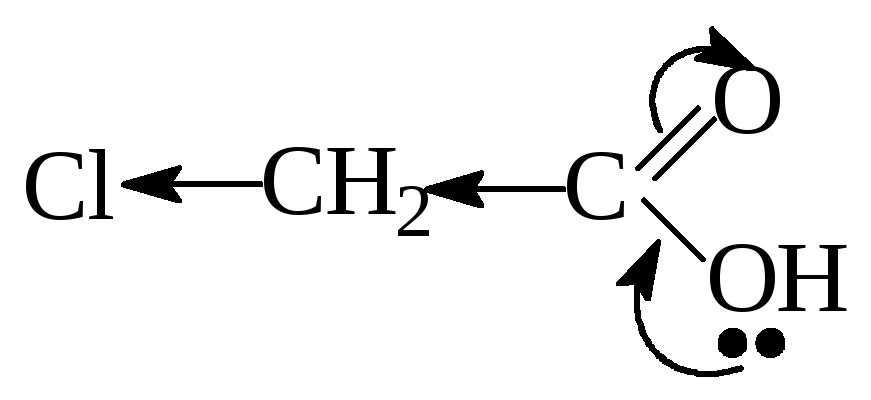
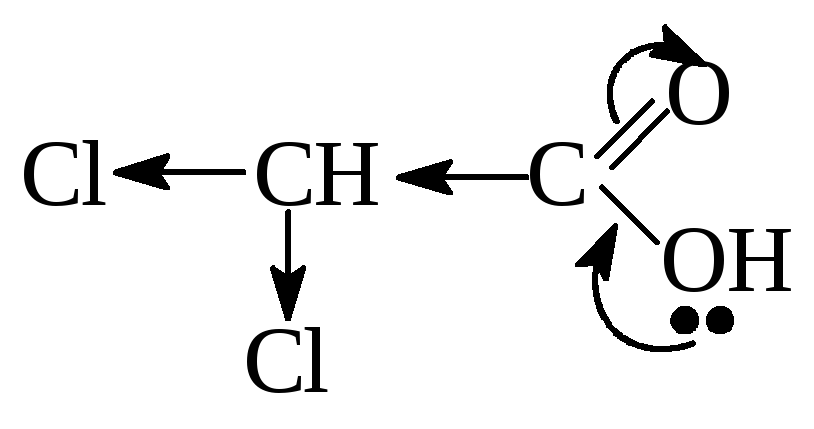
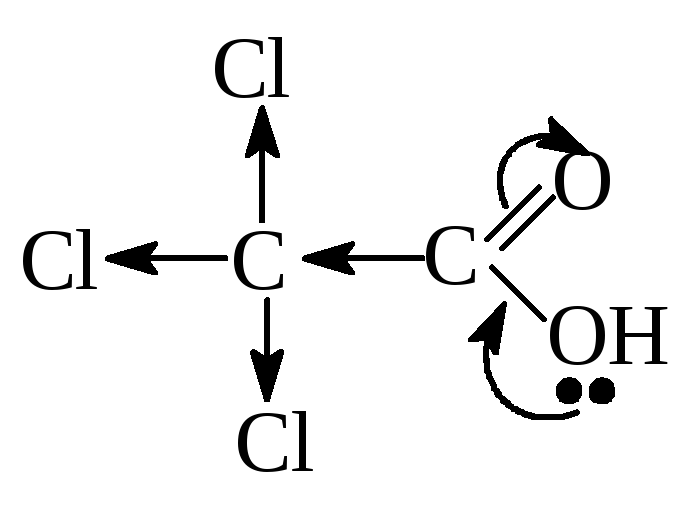
При введении Э.А.
заместителя в углеводородный радикал,
например хлора — кислотность соединения
увеличивается, т.к. за счет –I
эффекта происходит делокализация
электронной плотности и δ+
на атоме С карбоксильной группы
увеличивается, поэтому в данном примере
трихлоруксусная кислота будет самой
сильной.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
