Гидроксихинолины в каких лекарствах содержится
Образовавшуюся суспензию фильтруют от гипса в горячем виде и аммонийную соль N-метоксикарбонилсульфаниламида крмсталлизуют при 20°С. Выход до 93-94 %.
Аммонийную соль перегруппировывают в N-метоксикарбонилсульгин в твердой фазе при высокой температуре или (что наиболее технологично) в этиленгликоле при 140-180 °С с выходом до 80 %. Гидролиз N-метоксикарбониламингруппы можно проводить в водных растворах гидроксида кальция или лучше 2-2,5 % водным раствором едкого натра при 96-98 °С с выходом 75-80 %.
Общая схема синтеза сульгина по такому способу следующая:
Недостатком предложенного метода является применение трудно регенерируемого этиленгликоля.
Преимуществом подобной унификации является то, что на базе одинакового сырья можно получать норсульфазол, сульгин и другие сульфаниламиды (фталазол, сульфадимезин).
5.2.6. Некоторые другие методы производства сульфаниламидных препаратов
Помимо рассмотренных выше методов производства сульфаниламидных препаратов на базе ФУСХ и стрептоцида существуют и другие. Некоторые из них используют отдельные сульфаниламиды в качестве исходного сырья. К их числу относятся в первую очередь способы получения таких важных продуктов как сульфадимезин и фталазол.
Сульфадимезин в принципе легко получается ацилированием 4,6-диметил-2-аминопиримидина n-ацетиламинобензосульфохлоридом с последующим омылением защитной группы. Однако более целесообразным является метод конденсации сульгина с ацетилацетоном, например, в присутствии уксусной кислоты по схеме:
По окончании длительного кипячения реагентов массу разбавляют горячей водой и под вакуумом отгоняют воду с ацетилацетоном, не вошедшим в реакцию. Сульфадимезин после выделения или в реакционной массе (т.е. без выделения) переводят в натриевую соль водным раствором NaOH (pH 9,5-10) при 75-85 °С, раствор осветляют углем или гидросульфитом натрия, отделяют от угля и остатков сульгина, и сульфадимезин осаждают соляной кислотой при pH 6,7-7,0.
Продукт центрифугируют, промывают водой и сушат. Выход 70 % на ацетилацетон или 78 % на сульгин (с учетом его возврата).
Из водных отгонов, содержащих до 5 % ацетилацетона, химическим путем выделяют кальциевую соль ацетилацетона. Для этого отгоны смешивают с известковым молоком при 25-30 °С, образовавшийся осадок фильтруют и сушат при 40-45 °С (выход около 84% на загруженный ацетилацетон). Лучшие результаты достигаются при использовании растворов хлористого кальция и едкого натра (pH 10,5-11) при 20-30 °С с последующей кристаллизацией кальциевой соли ацетилацетона при 5 °С (выход до 96 %):
Качество кальциевой соли в обоих случаях одинаково (содержание основного вещества 81-85 %). Полученную кальциевую соль далее конденсируют с сульгином в присутствии уксусной кислоты при 100-102 °С в течение 24 ч. После отгонки ацетилацетона с водой технический сульфадимезин отфильтровывают и очищают через натриевую соль, как описано выше. Выход – 69% на сульгин.
Фталазол получают, используя уже имеющуюся сульфаниламидную структуру – норсульфазол.
При этом ацилирование аминогруппы норсульфазола может быть осуществлено:
- нагреванием норсульфазола с фталевым ангидридом в спирте;
- сплавлением тех же реагентов с последующей очисткой фталазола через натриевую соль;
- реакцией фталевого ангидрида или фталевой кислоты с норсульфазолом в водной среде. При этом для сдвига равновесия в сторону продуктов ацилирования требуется избыток фталевой кислоты.
В промышленности ацилирование норсульфазола ведут фталевой кислотой в воде при 78-80 °С в течение 6-10 ч. Кислоту получают гидролизом фталевого ангидрида и используют 20 % мольный избыток. Реакцию контролируют по расходу норсульфазола (проба на первичный амин):
При соблюдении требуемых параметров процесса фталазол получают без дополнительной очистки через натриевую соль. Образовавшийся осадок центрифугируют, тщательно отмывают горячей водой и сушат. Выход – 98 % на норсульфазол или 81 % на фталевую кислоту.
Существуют и другие методы химической модификации отдельных сульфаниламидных препаратов с получением новых лекарственных средств, которые здесь не рассматриваются.
5.2.7. Схема синтеза некоторых сульфаниламидных препаратов на основе n-нитробензолсульфохлорида
Замена ФУСХ на n-нитробензолсульфохлорид (НБСХ), который может быть получен из доступного n-нитрохлорбензола различными методами, позволяет решить проблему сокращения кислых отходов производства:
Анализ литературных данных показал, что пути I и II имеют ряд общих недостатков – низкие выходы НБСХ (20-50 %), образование побочных соединений, применение органических растворителей, значительное количество вредных отходов.
Наиболее интересный и практически значимый метод получения НБСХ включает диазотирование промежуточного n-нитроанилина (производится в крупных масштабах) в n-нитробензолдиазоний хлорид с последующей обработкой соли диазония сернистым ангидридом.
Было показано, что НБСХ гладко и с высоким выходом образуется при диазотировании раствора 1 моля n-нитроанилина в 35 % соляной кислоте (4,65 моль) при температуре до (-6) °С добавлением 37 % водного раствора нитрата натрия (1,1 моль) в течение 30-35 минут.
Полученную суспензию, содержащую хлористый n-нитробензолдиазоний, добавляют в предварительно приготовленный раствор сернистого ангидрида (5,3 моль) и сульфита меди (0,125 моль ) в 98 % уксусной кислоте с такой скоростью, чтобы выднление азота было не слишком бурным. При этом температура повышается до 20 °С.
После прекращения выделения азота реакционную массу разбавляют водой, выделившийся осадок НБСХ отфмльтровывают на друк-фильтре и промывают водой. Выход НБСХ – 82 % от теории на n-нитроанилин при содержании основного вещества 95-96 % от сухого веса.
При этом разработан метод, который позволяет регенерировать из маточного раствора до 65 % сернистого ангидрида и до 91 % уксусной кислоты. Это делает предложенный метод малоотходным, т.к. на 1 кг НБСХ образуется всего оеоло 7 л слабозагрязненных стоков, содержащих главным образом хлористый натрий.
Приемуществом применения НБСХ является его большая стабильность в сравнении с ФУСХ (срок годности 1 год 6 мес.).
Несмотря на то, что стоимость n-нитроанилина примерно в 3 раза выше стоимости фенилуретилана, экспериментально подтверждена экономическая целесообразность использования НБСХ в производстве сложных сульфаниламидов пролонгированного действия, где большой удельный вес в стоимости занимает синтез сложного гетероциклического фрагмента.
На основе n-нитробензолсульфохлорида были разработаны методы получения сульфадиметоксина, сульфаманометоксина и этазола по следующей общей схеме:
Для восстановления нитрогруппы пригодны все общие методы. Ацилирование в хлорбензоле применяется для получения этазола с выходом 78-81 % на НБСХ. Выход сульфадиметоксина и сульфамонометоксина, соответственно, 63 % и 84-86 % на соответствующие амины.
Синтез многих известных сульфаниламидных препаратов (стркптоцид, сульгин, норсульфазол, сульфадимезин и др.) с использованием НБСХ не экономичен, что является недостатком метода.
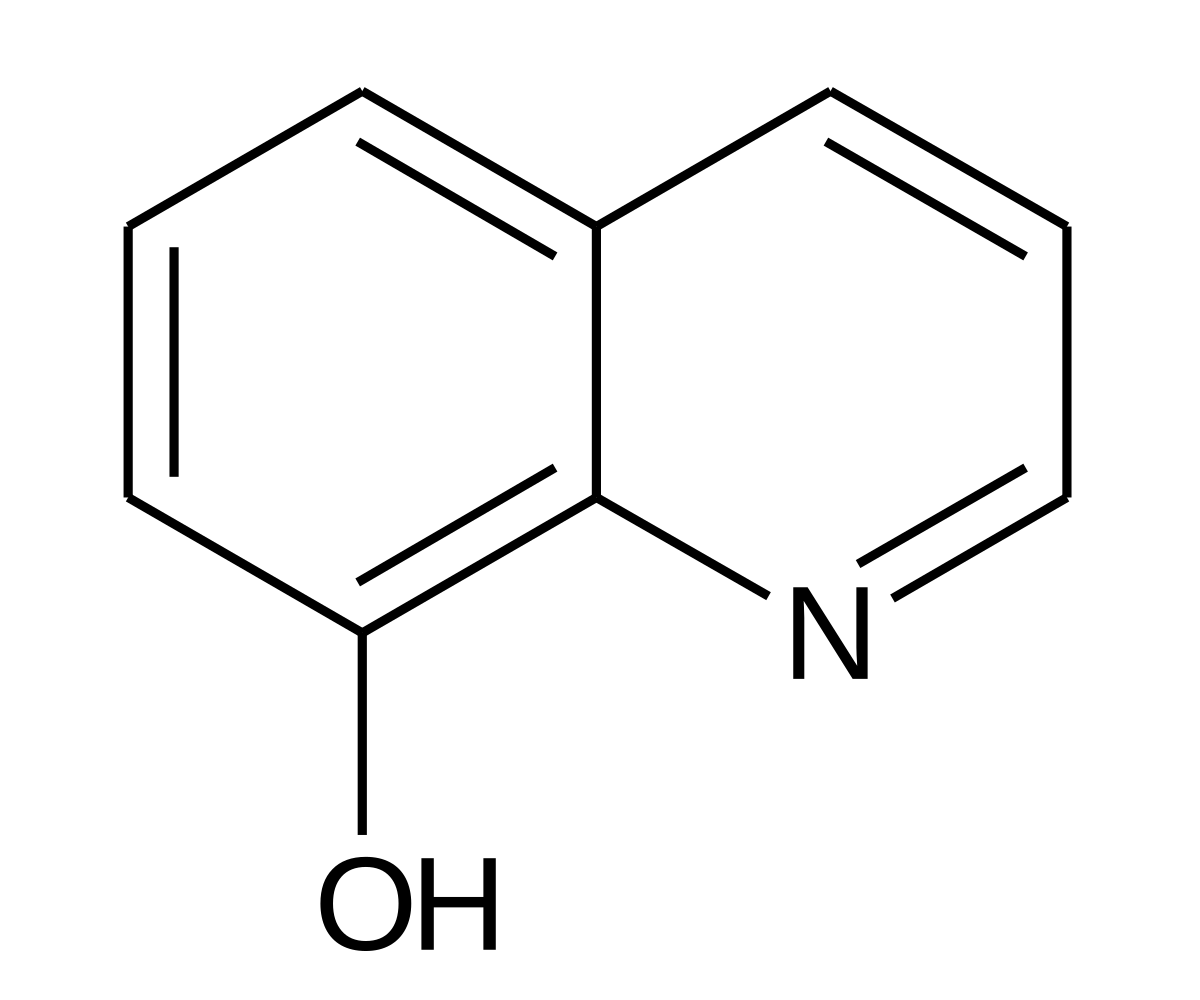
5.3. Производные 8-оксихинолина (8-гидроксихинолина)
Многие производные 8-оксихинолина (8-гидроксихинолина) обладают антибактериальной, противомикробной, противопаразитной и противогрибковой активностью, поэтому применяются в качестве химиотерапевтических и антисептических препаратов. Так давно известный препарат хинозол представляет собой соль 8-оксихинолина (8-гидроксихинолиний сульфат).
С середины 50-х годов в качестве пероральных антибактериальных и антипротозойных препаратов стали широко использовать производные 8-оксихинолина, содержащие галоген (хлор, бром, йод) в положениях 5 и 7. Широкую известность получили препараты энтеросептол (5-хлор-7-йод-8-оксихинолин) и содержащие энтеросептол в сочетании с другими субстанциями мексаза и мексаформ.
Эти препараты оказались эффективными для лечения кишечных инфекций (амебной и бактериальной дизентерии, протозойных колитов и других). Однако было установлено, что они (особенно при длительном применении) могут вызвать нарушения функций печени, почек и другие побочные явления. В связи с этим препараты данной группы стали использовать весьма ограниченно.
При кишечных инфекциях применяют также хлор хинальдол, а при урогенитальных инфекциях – нитроксолин.
Хлорхинальдол – 5,7-дихлор-2-метил-8-оксихинолин:
По химической структуре и механизму действия хлорхинальдол близок к выпускавшемуся ранее препарату энтеросептолу.
Нитроксолин (5-НОК) – 5-нитро-8-оксихинолин:
В отличие от других производных 8-оксихтнолина нитроксолин быстро всасывается из желудочно-кишечного тракта и выделяется в неизменном виде почками. В связи с выслкой концентрацией препарата в моче его применяют при инфекциях мочеполовых путей (пиелонефрите, цистите, уретрите, простатите и др.).
5.3.1. Синтез нитроксолина
Нитроксолин получают нитрозированием 8-оксихинолина нитритом натрия в присутствии разбавленной серной кислоты (pH = 1-2) с последующим окислением 5-нитрозо-8-оксихинолина – процесс ведут, исходя из хинозола.
Наиболее рациональным методом является следующая схема:
Нитрозирование ведут добавляя 35 % раствор нитрита натрия к раствору хинозола в 3,6 % серной кислоте при 18-20 °С. Реакционную массу выдерживают 3 ч., нейтрализуют 42 % раствором NaOH (до pH 8), а затем уксусной кислотой доводят pH до 3,5-4. Основание 5-нитрозо-8-гидроксихинолина отфильтровывают, суспензируют в воде и передают на окисление.
Окисление ведут постепенным добавлением к суспензии 5-нитрозо-8-оксихинолина 33 % азотной кислоты при температуре 38-40 °С в течение 2 ч. После анализа реакционной массы на содержание 5-НОК ее охлаждают до 18-20 °С, нейтрализуют 42 % раствором NaOH до pH 7,5-8 и подкисляют уксусной кислотой до pH 3-4. Выпавший осадок отфильтровывают и тщательно отмывают водой. Выход технического нитроксолина составляет 82-83 %, считая на хинозол.
Очистку 5-НОК ведут двукратной перекристаллизацией из ацетона с осветлением активированным углем. Выход после сушки около 63 % на хинозол.
Исходное сырье – хинозол – получают по методу Скраупа, взаимодействием о-аминофенола с глицерином в присутствии концентрированной серной кислоты. В качестве окислителя используют о-нитрофенол.
Серную кислоту загружают к смеси о-аминофенола с глицерином и о-нитрофенолом при температуре не выше 80 °С. Затем температуру поднимают до 80-115 °С и отгоняют воду, вновь массу инагревают до 135 °С и отгоняют о-нитрофенол с острым паром.
Остаток подщелачивают 42% раствором едкого натра до рН 7-7,5. Осадок 8-оксихинолина отфильтровывают, промывают, перегоняют под вакуумом и перекрисаллизовывают из ИПС с углём.
Для получения сульфата 8-оксихинолина к спиртовому раствору 8-оксихинолина добавляют раствор серной кислоты в спирте. Осадок отфильтровывают и промывают спитртом.
3. Производные 8-оксихинолина (8-гидроксихинолина)
Многие производные 8-оксихинолина (8-гидроксихинолина) обладают антибактериальной, противомикробной, противопаразитной и противогрибковой активностью, поэтому применяются в качестве химиотерапевтических и антисептических препаратов. Так давно известный препарат хинозол представляет собой соль 8-оксихинолина (8-гидроксихинолиний сульфат).
С середины 50-х годов в качестве пероральных антибактериальных и антипротозойных препаратов стали широко использовать производные 8-оксихинолина, содержащие галоген (хлор, бром, йод) в положениях 5 и 7. Широкую известность получили препараты энтеросептол (5-хлор-7-йод-8-оксихинолин) и содержащие энтеросептол в сочетании с другими субстанциями мексаза и мексаформ.
Эти препараты оказались эффективными для лечения кишечных инфекций (амебной и бактериальной дизентерии, протозойных колитов и других). Однако было установлено, что они (особенно при длительном применении) могут вызвать нарушения функций печени, почек и другие побочные явления. В связи с этим препараты данной группы стали использовать весьма ограниченно.
При кишечных инфекциях применяют также хлор хинальдол, а при урогенитальных инфекциях – нитроксолин.
Хлорхинальдол – 5,7-дихлор-2-метил-8-оксихинолин:
По химической структуре и механизму действия хлорхинальдол близок к выпускавшемуся ранее препарату энтеросептолу.
Нитроксолин (5-НОК) – 5-нитро-8-оксихинолин:
В отличие от других производных 8-оксихтнолина нитроксолин быстро всасывается из желудочно-кишечного тракта и выделяется в неизменном виде почками. В связи с выслкой концентрацией препарата в моче его применяют при инфекциях мочеполовых путей (пиелонефрите, цистите, уретрите, простатите и др.).
8-оксихинолин (ортооксихинолин, оксин) — гетероциклическое органическое соединение состава C9H7NO. В медицине оксихинолин ранее часто использовался в качестве противомикробного средства (группа оксихинолинов).
Физические свойства[править | править код]
Светло-жёлтые кристаллы; tпл75 — 76 °C, tкип267 °C; растворим в органических растворителях: в хлороформе 382 г/л, в бензоле 319 г/л, в изоамилацетате 174 г/л, этиловом эфире 96 г/л, изоамиловом спирте 56.6 г/л; в щелочах и кислотах, в воде — плохо (минимальная растворимость 0.53 г/л в изоэлектрической точке (pH=7.2)). Легко летуч с парами воды. Растворы 8-оксихинолина темнеют на свету, поэтому их следует хранить в тёмном прохладном месте.
Получение[править | править код]
Получают нагреванием гидрохлорида о-аминофенола и о-нитрофенола, глицерина и серной кислоты (модификация Реакции Скраупа[en]) или щелочным плавлением 8-хинолинсульфокислоты.
Применение[править | править код]
8-оксихинолин образует комплексные соединения более чем с 40 элементами периодической системы и является малоизбирательным групповым реагентом. Способность 8-оксихинолина образовывать со многими катионами металлов малорастворимые в водных растворах (уксусной кислоты, аммиака и др.) кристаллические внутрикомплексные соли (хелаты), например Mg(C9H6ON)2, Al (C9H6ON)3, используется на практике для определения и разделения ряда металлов (Al, Zn, Cd, Mg и др.).
Гидроксихниолинаты различных металлов различаются окраской и могут быть определены фотометрически. Хорошая их растворимость в хлороформе используется для экстрационно-фотометрического определения ряда элементов.
Некоторые производные 8-оксихинолина применяют в качестве фунгицидов [например, медную соль (C9H6ON)2Cu] и антисептиков амёбоцидного и наружного действия.
Комплекс 8-оксихинолина с алюминием используется для изготовления органических светодиодов (OLED). Вариации заместителей в хинолиновом ядре позволяют получать материалы с различными люминесцентными свойствами.[1]
Медицинское использование[править | править код]
Оксихинолин показан для дезинфекции рук, обработки ран, язв, микозов. Для обработки хирургического инструмента непригоден, так как взаимодействует с металлом.
При аппликации на кожу обеспечивается длительное противогрибковое действие (96 ч) на кожной поверхности. Активен в отношении различных видов дерматофитов (рода трихофитон, микроспорум, дрожжеподобных грибов, грибов рода пенициллиум и аспергилюс и др. возбудителями). Относительно малотоксичен, не оказывает местного раздражающего действия и не инактивируется белками тканей.
Для дезинфекции рук, промывания ран, язв, спринцеваний оксихинолин применяется в разведении 1:1000, 1:2000. При микозах — наружно, в виде аппликаций на пораженные участки кожи и ногтевые ложа после удаления ногтевых пластинок. Пластырь нужного размера и формы прикладывают липкой поверхностью на кожу или ногтевые ложа, предварительно слегка смоченные водой, прижимают для обеспечения контакта всей площади пластыря с пораженным участком. Длительность разовой аппликации — не более 4 сут, затем пластырь меняют, проводя в перерыве между аппликациями гигиенические процедуры. После третьей аппликации (через 12 дней) больным проводят чистку роговых наслоений при помощи мыльно-содовой ванны. Лечение проводят под контролем роста ногтевой пластинки и микроскопического исследования на грибы до получения не менее 3 отрицательных анализов с интервалом 1 мес. Продолжительность лечения зависит от сроков отрастания здоровых ногтевых пластинок и составляет от 3 до 10-12 мес.
На данный момент препараты на основе оксихинолина не имеют регистрации в России.
Литература[править | править код]
«Химическая энциклопедия». — под ред. Кнунянца Л. И. — М.: Большая российская энциклопедия, 1992, Т.3, стр.361
Примечания[править | править код]
- ↑ Montes, V. A.; Pohl, R.; Shinar, J.; Anzenbacher, P. Jr. Effective Manipulation of the Electronic Effects and Its Influence on the Emission of 5-Substituted Tris(8-quinolinolate) Aluminum(III) Complexes (англ.) // Chemistry — A European Journal (англ.)русск. : journal. — 2006. — Vol. 12, no. 17. — P. 4523—4535. — doi:10.1002/chem.200501403.
ЭНДРЮ ЧЕТЛИ. ПРОБЛЕМНЫЕ ЛЕКАРСТВА ЭНДРЮ ЧЕТЛИ. ПРОБЛЕМНЫЕ ЛЕКАРСТВА |
Содержание :: ANTIBIOTIC.ru
Всемирное изъятие … с опозданием на 20 лет
Когда девятнадцатилетняя Миеко Хоши [Mieko Hoshi] в июне 1969 г. заболела диареей, и врачи никак не могли улучшить ее состояние, девушке в конце концов дали галогенированный гидроксихинолин под названием йодохлоргидроксихин (известный как 5-хлор-7-йод-8-оксихинолин, фирменные названия Энтерасептол и Клиохинол). Вскоре после этого у нее наступил временный паралич лицевых мышц, из-за чего она на несколько дней потеряла способность говорить. Когда эта проблема исчезла, у нее появилось чувство онемения в ногах, которое все усиливалось и распространялось по всему телу, пока не привело почти к полному параличу. В октябре 1969 г. она также потеряла зрение. К началу 1970 г. стало ясно, что Миеко — одна из 11000 жертв заболевания под названием подострая миело-оптическая невропатия (ПМОН), которая между 1955 и 1970 гг. охватила всю Японию [1].
За эти 15 лет было потрачено много времени, чтобы обнаружить причину этого заболевания. 7 августа 1970 г. японские ученые сообщили, что возможной причиной был клиохинол. Не прошло и месяца, как японское правительство запретило все 186 галогенированных гидроксихинолинов на рынке лекарств [2].
Клиохинол был активным ингредиентом в таких широко применявшихся противодиарейных препаратах, как Энтеро-Виоформ и Мексаформ, предлагаемых швейцарской фирмой Ciba-Geigy. Впервые Ciba вывела на рынок клиохинол (Энтеросептол) в 1900 г. в качестве присыпки для ран под названием Виоформ. В 1934 г. Ciba предложила его для перорального использования под названием Энтеро-Виоформ. Прошел лишь год после появления препарата на рынке лекарств, как Ciba получила сообщение от аргентинских врачей, в котором описывались те же самые побочные эффекты, что наблюдались позднее у японских пациентов. Испытания на животных в конце 1930-х гг. показали, что препарат вызывал конвульсии у кошек. причем некоторые закончились смертью. В начале 1960-х гг. Ciba-Geigy получила материалы исследований, из которых было видно, что собаки с диареей, леченные Энтеро-Виоформом, умирали в конвульсиях. В 1966 г. др. Олле Ханссон [Olle Hansson] из Швеции вместе с одним шведским офтальмологом опубликовал сообщение в The Lancet об атрофии зрительного нерва и слепоте, причиной которых был этот препарат. В 1972 г. жертвы препарата из Японии подали в суд на Ciba-Geigy, но лишь шесть лет спустя фирма принесла им свои извинения и выплатила значительные суммы в возмещение ущерба [3].
Однако Ciba-Geigy отказывалась признать, что лекарство опасно. В пресс-релизе 1980 г. фирма утверждала, что «не имеется неопровержимых научных доказательств того, что клиохинол (Энтеросептол) вызывает ПМОН» [4]. В пресс-релизе говорилось, что согласие возместить ущерб пациентам в Японии «не противоречит решению и в дальнейшем предлагать продукты, содержащие клиохинол. Учитывая чрезвычайную редкость побочных эффектов за пределами Японии, Ciba-Geigy считает, что в японской эпидемии ПМОН 1955-70 гг. свою роль сыграли один или более дополнительных факторов… Такие продукты, как Энтеро-Виоформ и Мексаформ безвредны и надежны, если использовать их согласно указаниям.»
Медики высказывали иное мнение, чем Ciba-Geigy [5]. Клиницисты из Англии, Австралии, Швейцарии, Швеции, Дании, Нидерландов и США описывали пациентов, у которых развивались неврологические симптомы при приеме йодохлоргидроксихина, дийодогидроксихина или броксихинолина. У этих больных клинические симптомы, дозировки и продолжительность терапии были схожи с теми, которые отмечались в историях болезни японских пациентов с ПМОН [6]. Наряду с возрастающим количеством доказательств, связывающих гидроксихинолины с ПМОН, возникали сомнения в эффективности этих продуктов для лечения диареи. Один исследователь так говорит об отсутствии экспериментальных данных, свидетельствующих об эффективности использования гидроксихинолинов:
«В действительности, эти средства кажутся бесполезными при любом виде диареи, кроме амебной, и даже тогда они не являются лекарством выбора. Лекарственная токсичность с дегенерацией сетчатки оказалась высоким риском для такого неэффективного средства [7].»
Американская медицинская ассоциация утверждает следующее:
«Клиохинол (йодохлоргидроксилинЭнтеросептол) и иодохинол (дийодогидроксихин) применялись для профилактики «диареи путешественников», но доказательства их эффективности отсутствуют… Неразборчивое использование таких потенциально токсичных препаратов является неоправданным [8].»
Авторитетный фармацевтический справочник Мартиндейл [Martindale] с определенным оптимизмом отмечает, что «большинство пероральных препаратов группы галогенированных гидроксихинолинов были изъяты, после того как была установлена связь между клиохинолом и подострой миело-оптической невропатией (ПМОН)» [9].
Все фирмы непростительно медленно изымали с рынка эти опасные лекарства. Ciba-Geigy, на которую с начала 1970-х гг. оказывалось давление, в ноябре 1982 г. наконец объявила о своем намерении «свернуть» производство и продажу пероральных препаратов клиохинола в течение 3-5 лет. Фирма по-прежнему настаивала, что это решение не было связано с токсичностью лекарства, а скорее отражало новые разработки в лечении диарейных заболеваний. Др. Олле Хансон отметил, что это решение «запоздало на 15 лет» и должно было вступить в силу немедленно после его принятия [10]. В ноябре 1984 г. Ciba-Geigy объявила, что «ускорит» свою первоначальную программу и прекратит поставки этих продуктов «к концу первого квартала 1985 г.» [11].
Ведущий клинический фармаколог др. Эндрю Херксхаймер [Andrew Herxheimer] из Великобритании объяснил, что поскольку клиохинол десятилетиями был таким прибыльным лекарством, то когда обнаружилось, что он вызывает катастрофические неврологические последствия, фирма оказалась перед дилеммой. «Изъятие лекарства ослабило бы ее позицию с юридической точки зрения. Вероятно, это было основной причиной проводимой фирмой политики настойчивого отрицания опасностей лекарства и продолжающихся уверений в его пользе,» — сказал др. Херксхаймер. Он добавил, что объявление в 1982 г. о поэтапном изъятии «может спасти лицо фирмы, но за это придется платить еще несколькими годами неэффективного и опасного лечения. Задержка запрета клиохинола (Энтеросептола) уже стала скандальной: 12 лет прошло между большой трагедией, вызванной лекарствами, и запретом на применение этого лекарства. Зачем же добавлять еще 3-5 лет? Всем фирмам-изготовителям и распространителям гидроксихинолинов идея уже ясна: прекратить немедленно [12].»
Есть ли вообще польза?
Таблица 7.1 дает некоторое представление о большом количестве продуктов группы гидроксихинолинов, по-прежнему находившихся в 1988-89 гг. на рынке лекарств в качестве противодиарейных препаратов. Более 60 из них обнаружились в руководствах по назначению лекарств в странах Азии, Среднего Востока и Латинской Америки. Исследование, проведенное в 1990 г. в 12 странах Латинской Америки — Аргентине, Боливии, Бразилии, Чили, Колумбии, Коста-Рике, Эквадоре, Гватемале, Мексике, Перу, Уругвае и Венесуэле — выявило, что 12 % из всех 351 противодиарейных продуктов на рынке лекарств содержали клиохинол или иной гидроксихинолин [13]. Большинство продуктов в обоих исследованиях также содержали другие ингредиенты, такие как фталилсульфатиазол (Фталазол), стрептомицин, неомицин и сульфагуанидин (Сульгин), которые следует избегать при желудочно-кишечной инфекции, поскольку они могут продлевать, а не снижать время, необходимое для лечения диареи [14].
Таблица 7.1. Гидроксихинолины, имевшиеся в 1988-89 гг. в отдельных странах. Фирменное наименование (название фирмы) — ингредиенты
| ПРОДУКТЫ, СОДЕРЖАЩИЕ ЦИЛОХИНОЛ: |
|---|
ИНДИЯ:
|
ИНДОНЕЗИЯ:*
|
МЕКСИКА (1987):
|
СРЕДНИЙ ВОСТОК:
|
ТАИЛАНД:
|
| ПРОДУКТЫ, СОДЕРЖАЩИЕ ДРУГИЕ ГИДРОКСИХИНОЛИНЫ: |
ИНДИЯ:
|
ИНДОНЕЗИЯ:*
|
МЕКСИКА (1987):
|
ПАКИСТАН:
|
ТАИЛАНД:
|
* В октябре 1991 г. правительство Индонезии аннулировало ранее выданные регистрационные сертификаты 94 противодиарейных продуктов, многие из которых содержали противомикробные средства. Дополнительная информация дается в публикации: Без авт., «Daftar 285 Obat Yang Ditarik Dari Peredaran» (Список из 285 лекарств, изъятых из обращения), Suara Pembaruan, 29 окт. 1991.
Источники: Indonesian Index of Medical Specialists (Oct 1988); MIMS India (Feb 1988); MIMS Middle East (Dec 1989); Diccionario de Especialidades Farmaceuticas (Mexico, 1987); Quick Index of Medical Preparations (Pakistan, 1988-9); Thailand Index of Medical Specialities (Nov 1988)
Клиохинол и другие гидроксихинолины иногда также используются в мазях и кремах для кожи для лечения различных видов кожной сыпи. И опять — их использование вызывает сомнения. Клиохинол использовался в лечении редкой детской болезни кожи — acrodermatitis enteropathica. С 1973 г. существуют подтверждения, что эффективнее и безопаснее лечить ее солями цинка [15].
Недавние испытания в США с участием животных и людей показывают, что клиохинол, используемый в кремах для лечения опрелости у младенцев и других кожных состояний, легко всасывается в организме. В испытаниях на животных все леченные клиохинолом собаки теряли вес, становились апатичными и хуже реагировали на раздражители, а у четверых из них при обследовании обнаружилось нарушение функции печени. Одна собака погибла через 15 дней после лечения, а у другой развился паралич задних конечностей. Авторы исследования отметили, что этот паралич был идентичен тому, который описывался в сообщениях о пероральном употреблении клиохинола. Авторы делали вывод, что длительное накожное употребление этих лекарств, особенно при лечении опрелости у младенцев, может нанести вред печени [16].
Время действовать
Япония запретила все гидроксихинолины. Правительства некоторых других стран также предприняли действия в отношении этих лекарств. Клиохинол запрещен в Доминиканской республике, Гондурасе, Непале, США, Малайзии, Пакистане, Испании, Зимбабве; изъят из обращения в Италии, Норвегии, Голландии, Швеции; запрещено импортировать его в Саудовскую Аравию; и его использование ограничено в Австралии, Франции, Великобритании, Швейцарии, Замбии и на Кубе. Все производные гидроксихинолинов запрещены в Бангладеш; изъяты с рынка на Кипре, в Дании, Италии, Турции, на Филиппинах; и ограничены в Венесуэле [17].
На примере случая в Пакистане хорошо видна грозящая опасность, если гидроксихинолины не будут запрещены. После запрета правительством продуктов клиохинола в феврале 1984 г. фирма Wyeth/American Home Products с центром в США была вынуждена изъять с рынка свой продукт Энтокс, но в августе 1984 г. повторно ввела его на рынок в составе «не содержащего клиохинол» препарата. Клиохинол был заменен дийодогидроксихином. В материалах фирмы, изданных в то время, говорилось, что это «удобная, легко проглатывающаяся таблетка для большинства видов диареи» [18]. В последствии Wyeth опять изменила состав продукта, и к 1990 г. он содержал просто неэффективный адсорбент аттапульгин.
Угроза, которую гидроксихинолины по-прежнему представляют для здоровья, требует дальнейших незамедлительных действий. По словам др. Ханссона и др. Херксхаймера, уже в 1984 «всемирное изъятие всех пероральных продуктов, содержащих галогенированные гидроксихинолины, запаздывало на 10 лет [19].»
Недавно Всемирная Организация Здравоохранения высказалась о гидроксихинолинах так же жестко:
«Побочные эффекты, связанные с гидроксихинолинами, хотя и нечасты, но могут быть тяжелыми. Использование этих продуктов в лечении острой диареи и амебиоза не может быть оправдано, и следовательно, нет оснований для их дальнейшего производства и продажи» [20].
Рекомендации к действию
- Немедленный запрет всех пероральных продуктов, содержащих галогенированные гидроксихинолины.
- Приостановление сбыта всех кремов для кожи, содержащих галогенированные гидроксихинолины, до тех пор, пока не будет получено новых недежных данных об их нетоксичности.
Источники
- Hansson, О., Inside Ciba-Geigy, Penang, International Organization of Consumers Unions, 1989, pp3-6 & 13.
- Ibid., pp6-10.
- Ibid., pp14-40.
- Anon., «Round the World», Lancet, 14 June 1980, p1293.
- Claeson, M.E. and Clements, M.L., «Ridding the world of hydroxyquinolines», British Medical Journal, Vol 299,26 Aug 1989, pp527-8.
- Hansson, O., op cit, p44.
- Rohde, J. E., «Selective primary health care: strategies for control of disease in the developing world. XV. Acute diarrhoea», Reviews of Infectious Diseases, Vol 6, No 6, Nov-Dec 1984, pp840-54.
- AMA, Drug Evaluations, Philadelphia, W.B. Saunders Co., (6th edn) 1986, p964.
- Reynolds, J.E.F. (ed.), Martindale: The Extra Pharmacopoeia, London, The Pharmaceutical Press, (29th edn) 1989, p658.
- Anon., «Ciba-Geigy to Õphase-out’ clioquinol», HAI News, No 8, Dec 1982.
- Hansson, O., op cit, p89.
- Herxheimer, A., «Clioquinol: A slow withdrawal is not good enough», HAI News, No 9, Feb 1983.
- Lanza, O. and Kerkvliet, E., Ojo con los antidiarreicos: el abuso de antidiarreicos en América Latina, Montevideo, AIS/IOCU, 1991, pp35-40.
- BMA and the Royal Pharmaceutical Society of Great Britain, British National Formulary, London, BMA and The Pharmaceutical Press, No 21, Mar 1991, p36.
- Anon., Bad Information Means Bad Medicine, London, Social Audit, 1981.
- Greenberg, A., et al, Citizen’s petition, submitted to the US Food and Drug Administration, on behalf of the Public Citizen Health Research Group, 24 July 1985.
- United Nations, Consolidated List of Products Whose Consumption and/or Sale Have Been Banned, Withdrawn, Severely Restricted or Not Approved by Governments, 2nd issue, Doc No ST/ESA/192, New York, 1987, pp29-30 & 75.
Anon., «The name of the game», New Internationalist, Apr 1981, p6.
Anon., «Ciba to withdraw clioquinol», Utusan Konsumer, Apr 1983.
Anon., «Clioquinol-free reformulated Entox now available», Pharma News (Karachi), 15-31 Aug 1984.
Anon., «Spain for rational drug use: 111 drugs banned», HAI News, No 14, Dec 1983.
Ahmad, S.R., Bitter Facts About Drugs, Karachi, HAI Pakistan, 1990, ррЗЗ-4. - Hansson, O. and Herxheimer, A., «Halogenated hydroxyquinolines: still no end», Lancet, 13 Oct 1984, p864.
- Ibid.
- WHO, The rational use of drugs in the management of acute diarrhoea in children, Geneva, WHO, 1990, p40.
