Гидроксид стронция какие свойства проявляет

гидроксид стронция (Sr (OH) ₂) — неорганическое химическое соединение, состоящее из иона стронция (Sr) и двух ионов гидроксида (OH). Это соединение получают путем объединения соли стронция с сильным основанием, в результате чего получается соединение щелочной природы, химическая формула которого Sr (OH)2.
Обычно гидроксид натрия (NaOH) или гидроксид калия (KOH) используют в качестве сильного основания для получения гидроксида стронция. С другой стороны, солью стронция (или ионом стронция), который реагирует с сильным основанием, является нитрат стронция Sr (NO3)2 и процесс описывается следующей химической реакцией:
2KOH + Sr (НЕТ3)2 → 2KNO3 + Sr (OH)2
В растворе катион стронция (Sr+) приводится в контакт с гидроксид-анионом (ОН-) образуя основную ионную соль стронция. Поскольку стронций является щелочноземельным металлом, гидроксид стронция считается едким щелочным соединением.
индекс
- 1 Получение
- 2 Химическая структура и физико-химические свойства
- 2.1 Октагидрат гидроксида стронция
- 2.2 Моногидрат гидроксида стронция
- 2.3 Безводный гидроксид стронция
- 2.4 Растворимость
- 2.5 Химическая реактивность
- 3 использования
- 3.1 Извлечение мелассы и рафинирование сахарной свеклы
- 3.2 Стронциевые жиры
- 3.3 Пластиковый стабилизатор
- 3.4 Другие приложения
- 4 Ссылки
получение
В дополнение к описанному ранее процессу можно сказать, что после проведения реакции Sr (OH)2 осаждается в растворе. Затем его подвергают процессу стирки и сушки, в результате чего получают очень тонкий белый порошок..
Альтернативный способ получения гидроксида стронция заключается в нагревании карбоната стронция (SrCO)3) или сульфат стронция (SrSO)4) с паром при температуре от 500 до 600 ° С Химическая реакция происходит, как показано ниже:
SrCO3 + H2O → Sr (OH)2 + Колорадо2
SrS + 2H2O → Sr (OH)2 + H2S
Химическая структура и физико-химические свойства
В настоящее время известны 3 формы гидроксида стронция: октагидрат, моногидрат и безводный..
Октагидрат гидроксида стронция
Из растворов при нормальных условиях температуры и давления (25 ° C и 1 атм) гидроксид стронция осаждается в октагидратированной форме, химическая формула которой Sr (OH)2H 8H2О.
Это соединение имеет молярную массу 265,76 г / моль, плотность 1,90 г / см и осаждается в виде тетрагональных кристаллов (с пространственной группой P4 / ncc) четырехугольного и бесцветного призматического вида..
Кроме того, октагидрат гидроксида стронция обладает способностью поглощать атмосферную влагу, так как является легко растекающимся соединением..
Моногидрат гидроксида стронция
По данным оптических микроскопических исследований (выполненных с использованием техники дифракции рентгеновских лучей), путем повышения температуры примерно до 210 ° С — при постоянном атмосферном давлении — Sr (OH)2H 8H2Или он обезвоживается и превращается в моногидрат гидроксида стронция (Sr (OH)2∙ H2O).
Эта форма соединения имеет молярную массу 139,65 г / моль, а его температура плавления составляет -73,15 ° С (375 К). Из-за своей атомной конфигурации он обладает более низкой растворимостью в воде, чем описано в октагидратированной форме..
Безводный гидроксид стронция
Продолжая повышать температуру системы до примерно 480 ° С, дегидратацию продолжают до тех пор, пока не будет получен безводный гидроксид стронция..
В отличие от его гидратированных форм, он имеет молярную массу 121,63 г / моль и плотность 3,625 г / см.3. Его температура кипения достигается при 710 ° C (1310 ° F или 983 K), в то время как температура плавления составляет 535 ° C (995 ° F или 808 K)..
растворимость
Октагидратированный гидроксид стронция имеет растворимость в воде 0,91 грамма на 100 миллилитров (измерено при 0 ° C), в то время как его безводная форма при аналогичных температурных условиях имеет растворимость 0,41 грамма на 100 миллилитров..
Таким же образом, это вещество считается нерастворимым в ацетоне и полностью растворимым в кислотах и хлориде аммония..
Химическая реактивность
Гидроксид стронция не горюч, его химическая реакционная способность остается стабильной при умеренных температурах и давлениях и способен поглощать диоксид углерода из атмосферного воздуха, превращая его в карбонат стронция..
Кроме того, это сильно раздражающее соединение, если оно вступает в контакт с кожей, дыхательными путями или другими слизистыми оболочками тела..
приложений
Благодаря своим гигроскопическим характеристикам и основным свойствам, гидроксид стронция используется для различных применений в промышленности:
- Извлечение мелассы и рафинирование сахара из свеклы.
- Пластиковый стабилизатор.
- Смазки и смазки.
Извлечение мелассы и рафинирование сахарной свеклы
В начале XXI века гидроксид стронция использовался в Германии для рафинирования сахара из свеклы по технологии, запатентованной Карлом Шейблером в 1882 году..
Этот процесс состоит из смешивания гидроксида стронция и сахарной пульпы свеклы, что приводит к нерастворимому дисахариду. Этот раствор отделяют декантированием, и после завершения процесса рафинирования в качестве конечного продукта получают сахар..
Несмотря на то, что эта процедура все еще используется сегодня, существуют другие методы с гораздо большим спросом, потому что они дешевле, которые используются на подавляющем большинстве мировых сахарных заводов. Например, метод Барсил, в котором используется силикат бария, или метод Штеффена с использованием Cal в качестве экстрактора.
Стронциевые смазки
Это смазки, содержащие гидроксид стронция. Они способны прочно сцепляться с поверхностями с металлическими характеристиками, устойчивы к воде и выдерживают резкие перепады температур.
Благодаря хорошей физической и химической стабильности эти жиры используются в качестве промышленных смазочных материалов..
Пластиковый стабилизатор
Подавляющее большинство пластмасс при воздействии климатических факторов, таких как солнце, дождь и атмосферный кислород, изменяют их свойства и ухудшают качество.
Из-за значительной устойчивости к воде в эти полимеры добавляется гидроксид стронция — во время фазы плавления — выступает в качестве стабилизатора при производстве изделий из пластмасс для продления срока их службы..
Другие приложения
- В лакокрасочной промышленности его используют в качестве необходимой добавки для ускорения процесса высыхания в коммерческих и промышленных красках..
- Соли стронция или ионы стронция получают из гидроксида стронция и используются в качестве сырья для производства пиротехнических изделий..
ссылки
- Wikipedia. (Н.Д.). Гидроксид стронция. Получено с en.wikipedia.org
- PubChem. (Н.Д.). Гидроксид стронция. Получено из pubchem.ncbi.nlm.nih.gov
- Ламберт И. и Клевер Х. Л. (2013). Гидроксиды щелочноземельных металлов в воде и водных растворах. Получено из books.google.co.ve
- Кребс Р. Э. (2006). История и использование химических элементов нашей Земли: справочное руководство. Получено из books.google.co.ve
- Honeywell. (Н.Д.). Октагидрат гидроксида стронция. Восстановленный от honeywell.com
Гидроксид стронция — неорганическое основание (щёлочь), состоящее из одного иона стронция и двух гидроксид-ионов, имеющее химическую формулу Sr(OH)2.
Физические свойства
Бесцветные гигроскопичные кристаллы тетрагональной сингонии. Малорастворим в воде (0,41 грамм/100 мл при 0 °C). Растворимость повышается в присутствии NH4Cl.
Образует кристаллогидраты Sr(OH)2•H2O и Sr(OH)2•8H2O.
Получение
- В лаборатории: действием при охлаждении на растворимые соли стронция гидроксида натрия:
<math>mathsf{Sr(NO_3)_2 + 2NaOH rightarrow Sr(OH)_2 + 2NaNO_3}</math>
- В промышленности: реакцией SrO c водой:
<math>mathsf{SrO + H_2O rightarrow Sr(OH)_2}</math>
Химические свойства
- Как сильное основание реагирует с кислотами и кислотными оксидами с образованием соответствующих солей.
- При нагревании свыше 700 °C разлагается:
<math>mathsf{Sr(OH)_2 rightarrow SrO + H_2O}</math>
- При действии на кристаллический Sr(OH)2 концентрированной H2O2 образует пероксид стронция SrO2•8H2O.
Применение
Гидроксид стронция используется в основном для очистки свекловичного сахара, а также в качестве стабилизатора для производства пластмасс. Может использоваться как источник ионов стронция, когда нежелательно присутствие ионов хлора. Промежуточный продукт для получения карбоната стронция.
Напишите отзыв о статье «Гидроксид стронция»
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Отрывок, характеризующий Гидроксид стронция
– Ах, какой ужас! – сказала, со двора возвративись, иззябшая и испуганная Соня. – Я думаю, вся Москва сгорит, ужасное зарево! Наташа, посмотри теперь, отсюда из окошка видно, – сказала она сестре, видимо, желая чем нибудь развлечь ее. Но Наташа посмотрела на нее, как бы не понимая того, что у ней спрашивали, и опять уставилась глазами в угол печи. Наташа находилась в этом состоянии столбняка с нынешнего утра, с того самого времени, как Соня, к удивлению и досаде графини, непонятно для чего, нашла нужным объявить Наташе о ране князя Андрея и о его присутствии с ними в поезде. Графиня рассердилась на Соню, как она редко сердилась. Соня плакала и просила прощенья и теперь, как бы стараясь загладить свою вину, не переставая ухаживала за сестрой.
– Посмотри, Наташа, как ужасно горит, – сказала Соня.
– Что горит? – спросила Наташа. – Ах, да, Москва.
И как бы для того, чтобы не обидеть Сони отказом и отделаться от нее, она подвинула голову к окну, поглядела так, что, очевидно, не могла ничего видеть, и опять села в свое прежнее положение.
– Да ты не видела?
– Нет, право, я видела, – умоляющим о спокойствии голосом сказала она.
И графине и Соне понятно было, что Москва, пожар Москвы, что бы то ни было, конечно, не могло иметь значения для Наташи.
Граф опять пошел за перегородку и лег. Графиня подошла к Наташе, дотронулась перевернутой рукой до ее головы, как это она делала, когда дочь ее бывала больна, потом дотронулась до ее лба губами, как бы для того, чтобы узнать, есть ли жар, и поцеловала ее.
– Ты озябла. Ты вся дрожишь. Ты бы ложилась, – сказала она.
– Ложиться? Да, хорошо, я лягу. Я сейчас лягу, – сказала Наташа.
С тех пор как Наташе в нынешнее утро сказали о том, что князь Андрей тяжело ранен и едет с ними, она только в первую минуту много спрашивала о том, куда? как? опасно ли он ранен? и можно ли ей видеть его? Но после того как ей сказали, что видеть его ей нельзя, что он ранен тяжело, но что жизнь его не в опасности, она, очевидно, не поверив тому, что ей говорили, но убедившись, что сколько бы она ни говорила, ей будут отвечать одно и то же, перестала спрашивать и говорить. Всю дорогу с большими глазами, которые так знала и которых выражения так боялась графиня, Наташа сидела неподвижно в углу кареты и так же сидела теперь на лавке, на которую села. Что то она задумывала, что то она решала или уже решила в своем уме теперь, – это знала графиня, но что это такое было, она не знала, и это то страшило и мучило ее.
– Наташа, разденься, голубушка, ложись на мою постель. (Только графине одной была постелена постель на кровати; m me Schoss и обе барышни должны были спать на полу на сене.)
3. Гидроксиды
Среди
многоэлементных
соединений важную группу составляют гидроксиды. Некоторые из них
проявляют
свойства оснований (основные гидроксиды) – NaOH, Ba(OH)2
и т.п.; другие
проявляют свойства кислот (кислотные гидроксиды) – HNO3, H3PO4 и другие.
Существуют и амфотерные гидроксиды,
способные в зависимости от условий проявлять как свойства оснований,
так и
свойства кислот – Zn(OH)2,
Al(OH) 3
и т.п.
3.1.
Классификация,
получение и свойства оснований
Основаниями
(основными
гидроксидами) с позиции теории электролитической диссоциации являются
вещества,
диссоциирующие в растворах с образованием гидроксид-ионов ОН—.
По современной
номенклатуре их принято называть гидроксидами элементов с указанием,
если
необходимо, валентности элемента (римскими цифрами в скобках): КОН
– гидроксид
калия, гидроксид натрия NaOH,
гидроксид кальция Ca(OH)2,
гидроксид хрома (II) – Cr(OH)2,
гидроксид хрома (III) – Cr(OH)3.
Гидроксиды
металлов принято делить
на две группы: растворимые
в воде (образованные щелочными и щелочноземельными металлами
— Li, Na, K, Cs, Rb, Fr, Ca, Sr, Ba и поэтому
называемые щелочами) и нерастворимые в воде.
Основное различие между
ними заключается в том, что концентрация ионов ОН- в растворах
щелочей достаточно
высока, для нерастворимых же оснований она определяется растворимостью
вещества
и обычно очень мала. Тем не менее, небольшие равновесные концентрации
иона ОН- даже в
растворах нерастворимых
оснований определяют свойства этого класса соединений.
По числу
гидроксильных
групп (кислотность),
способных замещаться на кислотный остаток, различают:
— однокислотные
основания
– KOH, NaOH;
— двухкислотные
основания
– Fe(OH)2,
Ba(OH)2;
— трехкислотные
основания
– Al(OH)3,
Fe(OH)3.
Получение
оснований
1. Общим методом
получения оснований является реакция обмена, с помощью которой могут
быть
получены как нерастворимые, так и растворимые основания:
CuSO4
+ 2KOH = Cu(OH)2↓
+ K2SO4,
K2SO4
+ Ba(OH)2 = 2KOH + BaCO3↓.
При получении
этим
методом растворимых оснований в осадок выпадает нерастворимая соль.
При получении
нерастворимых в воде оснований, обладающих амфотерными свойствами,
следует
избегать избытка щелочи, так как может произойти растворение
амфотерного
основания, например,
AlCl3
+ 3KOH = Al(OH)3 + 3KCl,
Al(OH)3
+ KOH = K[Al(OH)4].
В подобных
случаях для
получения гидроксидов используют гидроксид аммония, в котором
амфотерные оксиды
не растворяются:
AlCl3
+ 3NH4OH
= Al(OH)3↓
+ 3NH4Cl.
Гидроксиды
серебра, ртути
настолько легко распадаются, что при попытке их получения обменной
реакцией
вместо гидроксидов выпадают оксиды:
2AgNO3
+ 2KOH = Ag2O↓
+ H2O + 2KNO3.
2. Щелочи в
технике
обычно получают электролизом водных растворов хлоридов:
2NaCl
+ 2H2O = 2NaOH + H2 + Cl2.
(суммарная
реакция электролиза)
Щелочи могут
быть также
получены взаимодействием щелочных и щелочноземельных металлов или их
оксидов с
водой:
2Li + 2H2O = 2LiOH + H2↑,
SrO + H2O = Sr(OH)2.
Химические
свойства оснований
1. Все
нерастворимые в
воде основания при нагревании разлагаются с образованием оксидов:
2Fe(OH)3
= Fe2O3 + 3H2O,
Ca(OH)2
= CaO + H2O.
2. Наиболее
характерной
реакцией оснований является их взаимодействие с кислотами –
реакция
нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
NaOH + HNO3 = NaNO3 + H2O,
Cu(OH)2
+ H2SO4 = CuSO4
+ 2H2O.
3. Щелочи
взаимодействуют
с кислотными и с амфотерными оксидами:
2KOH
+ CO2 = K2CO3
+ H2O,
2NaOH
+ Al2O3 = 2NaAlO2
+ H2O.
4. Основания
могут
вступать в реакцию с кислыми солями:
2NaHSO3
+ 2KOH = Na2SO3 + K2SO3
+2H2O,
Ca(HCO3)2
+ Ba(OH)2 = BaCO3↓
+ CaCO3 + 2H2O.
Cu(OH)2
+ 2NaHSO4 = CuSO4 + Na2SO4
+2H2O.
5. Необходимо
особенно
подчеркнуть способность растворов щелочей реагировать с некоторыми
неметаллами
(галогенами, серой, белым фосфором, кремнием):
2NaOH + Cl2 = NaCl +NaOCl + H2O (на
холоду),
6KOH + 3Cl2 = 5KCl
+
KClO3 + 3H2O (при
нагревании),
6KOH
+ 3S = K2SO3 + 2K2S
+ 3H2O,
3KOH
+ 4P + 3H2O = PH3↑
+ 3KH2PO2,
2NaOH
+ Si + H2O = Na2SiO3
+ 2H2↑.
6. Кроме того,
концентрированные растворы щелочей при нагревании способны растворять
также и
некоторые металлы (те, соединения которых обладают амфотерными
свойствами):
2Al
+ 2NaOH + 6H2O = 2Na[Al(OH)4]
+ 3H2↑,
Zn
+ 2KOH + 2H2O = K2[Zn(OH)4]
+ H2↑.
Растворы щелочей
имеют рН
> 7 (щелочная среда), изменяют
окраску индикаторов
(лакмус – синяя, фенолфталеин – фиолетовая).
© М.В. Андрюxoва, Л.Н. Бopoдина
К следующему разделу
К оглавлению
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются
легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств,
реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
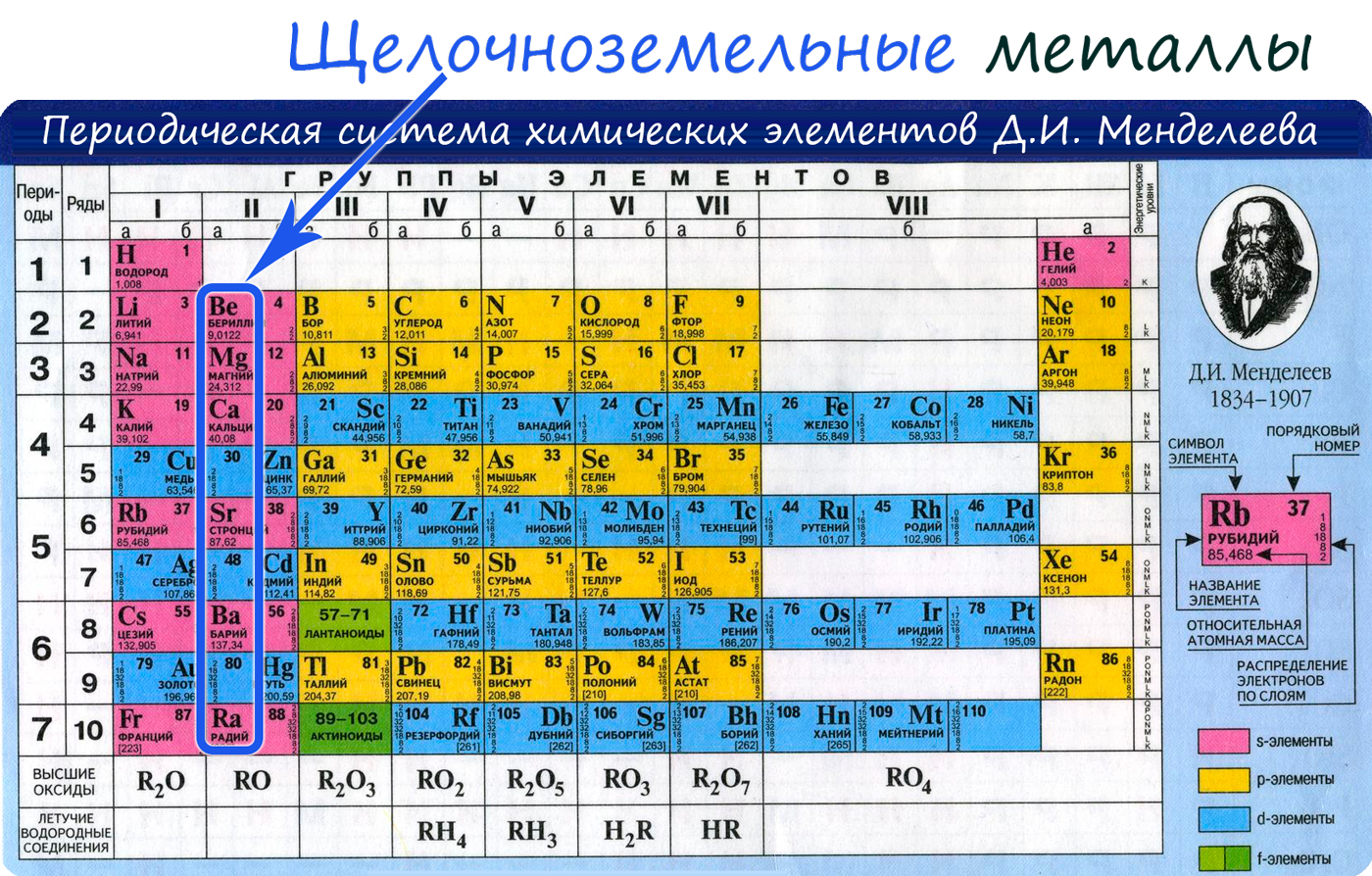
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2:
- Be — 2s2
- Mg — 3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Природные соединения
В природе щелочноземельные металлы встречаются в виде следующих соединений:
- Be — BeO*Al2O3*6SiO2 — берилл
- Mg — MgCO3 — магнезит, MgO*Al2O3 — шпинель, 2MgO*SiO2 — оливин
- Ca — CaCO3 — мел, мрамор, известняк, кальцит, CaSO4*2H2O — гипс, CaF2 — флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов,
алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия — способ получения металлов путем восстановления их оксидов алюминием)
MgBr2 + Ca → CaBr2 + Mg

Химические свойства
- Реакции с водой
- Реакции с кислотами
- Реакции с неметаллами
- С оксидами других металлов
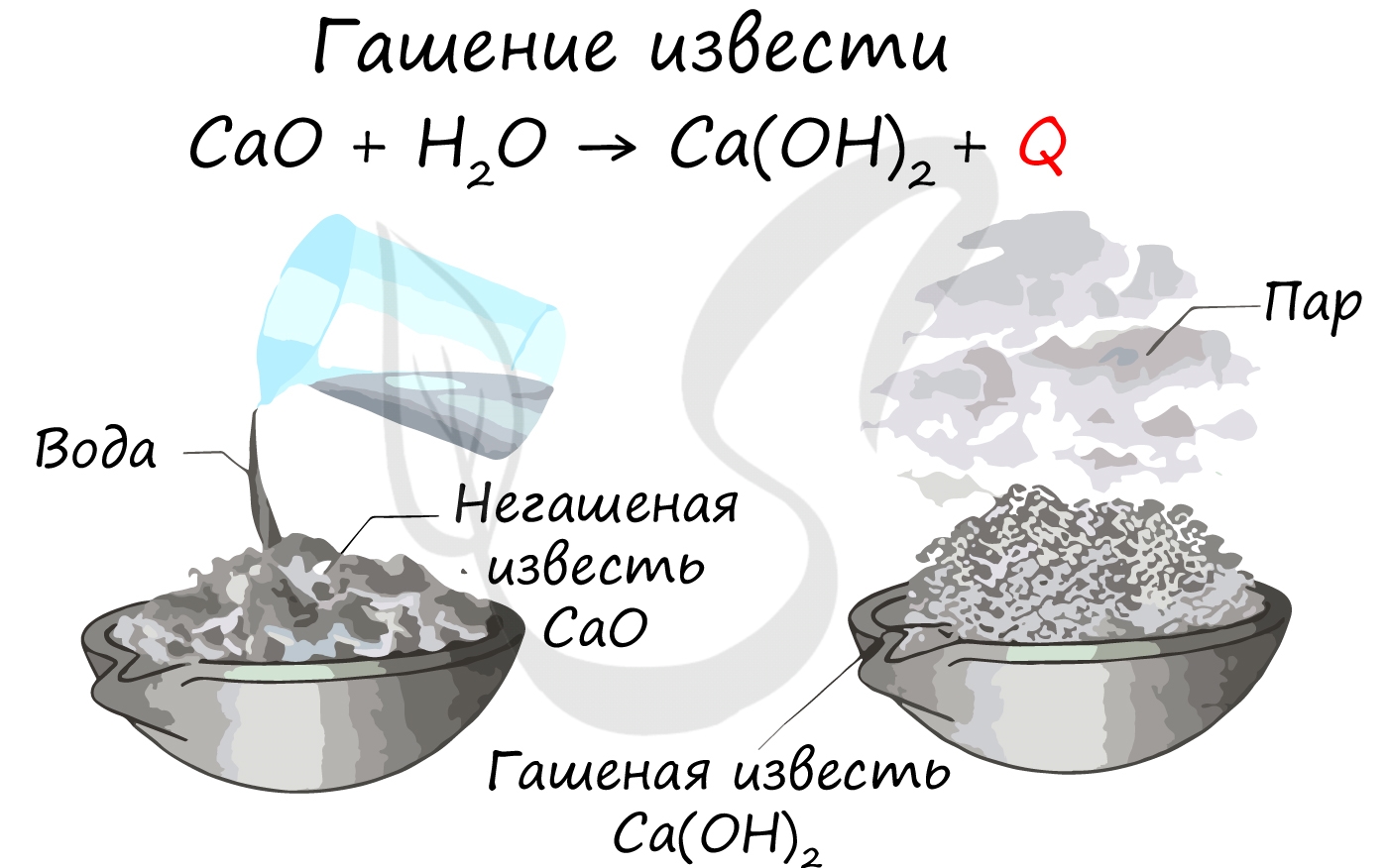
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов.
Магний реагирует с водой только при нагревании.
Ca + H2O → Ca(OH)2 + H2↑
Щелочноземельные металлы — активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород
из кислот:
Ba + HCl → BaCl2 + H2
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I), серой. Степень окисления у щелочноземельных
металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
Ca + I2 → CaI2 (йодид кальция)
Mg + S → MgS (сульфид магния)
При нагревании реагируют с азотом, водородом и углеродом.
Ca + N2 → (t) Ca3N2 (нитрид кальция)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
MgCO3 → (t) MgO + CO2
Ca(NO3)2 → (t) CaO + O2 + NO2
Рекомендую взять на вооружение общую схему разложения нитратов:

Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO — амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
- Реакция с водой
- Амфотерный оксид бериллия
BaO + HCl → BaCl2 + H2O
CaO + H2SO4 → CaSO4 + H2O
MgO + SO3 → MgSO4
CaO + CO2 → CaCO3
CaO + SiO2 → CaSiO3
В нее вступают все, кроме оксида бериллия.
CaO + H2O → Ca(OH)2
MgO + H2O → Mg(OH)2
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей,
и с основаниями с образованием комплексных солей.
BeO + HCl → BeCl2 + H2O
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)
BeO + Na2O → Na2BeO2

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия — амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
CaO + H2O → Ca(OH)2
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.
Ba(OH)2 + H2SO4 → BaSO4↓ + H2O
Ca(OH)2 + H2O + CO2 → Ca(HCO3)2 + H2O
Ca(HCO3)2 + Ca(OH)2 → CaCO3 + H2O + CO2
Ca(OH)2 + CO2 → CaCO3↓ + H2O

Реакция с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется
слабый электролит (вода).
Ba(OH)2 + Na2SO4 → BaSO4↓ + NaOH
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Be(OH)2 + HCl → BeCl2 + H2O
Be(OH)2 + NaOH → Na2[Be(OH)4]
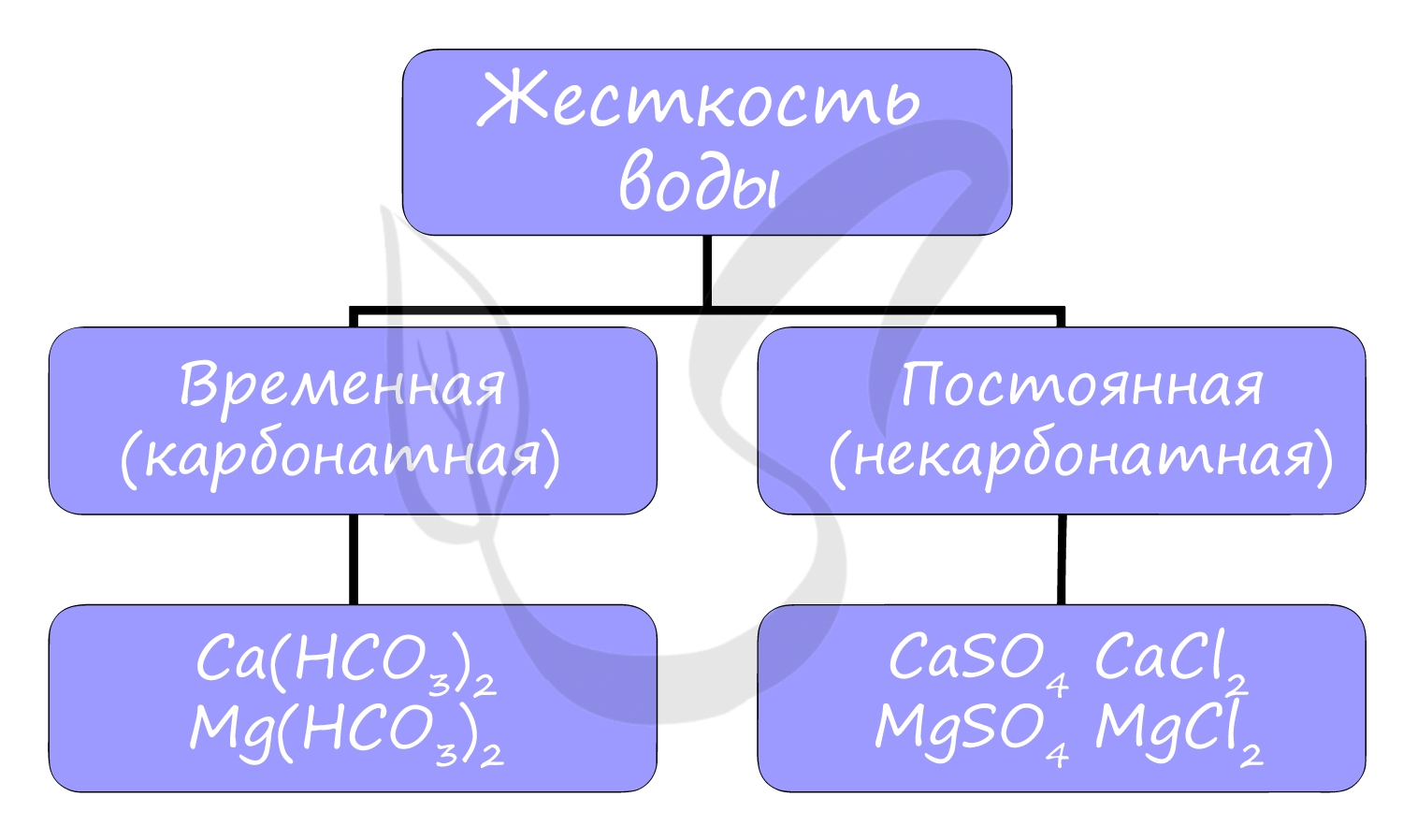
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящая от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов,
сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить — каждый день. Временная жесткость воды устраняется
обычным кипячением воды в чайнике, и известь на его стенках — CaCO3 — бесспорное доказательство устранения жесткости:
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + NaHCO3
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную
жесткость воды устраняют добавлением в воду Na2CO3:
CaCl2 + Na2CO3 → CaCO3↓ + NaCl
MgSO4 + Na2CO3 + H2O → [Mg(OH)]2CO3↓ + CO2↑ + Na2SO4
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках
котлов, труб, чайника.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
