Что такое озон какие свойства
У этого термина существуют и другие значения, см. Озон (значения).
| Озон | |||
|---|---|---|---|
| Систематическое наименование | Трикислород | ||
| Хим. формула | O3 | ||
| Состояние | голубой газ | ||
| Молярная масса | 47,998 г/моль | ||
| Плотность | 0,0021445 г/см3 (г., 0°C); 1,59(7) г/см3 (ж., 85,2 К); 1,73(2) г/см3 (тв., 77,4 К)[1] | ||
| Поверхностное натяжение | 43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м | ||
| Динамическая вязкость | 4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] | ||
| Энергия ионизации | 12,52 ± 0,01 эВ[3] | ||
| Температура | |||
| • плавления | −197,2 °C | ||
| • кипения | −111,9 °C | ||
| Критическая точка | |||
| • температура | −12,0 °С (261,1 К)[1] °C | ||
| • давление | 54,6 атм.[1] | ||
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль | ||
| Коэфф. тепл. расширения | 2,0·10−3 К−1 (ж., 90,1 К) 2,5·10−3 К−1 (ж., 161 К)[1] | ||
| Давление пара | 1 ± 1 атм[3] | ||
| Растворимость | |||
| • в воде | 1,06 г/л (при 0 °С)[2] | ||
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж)[1] | ||
| Показатель преломления | 1,0533 (г., 480 нм) 1,0520 (г., 546 нм) 1,0502 (г., 671 нм) 1,2236 (ж., 535 нм) 1,2226 (ж., 589 нм) 1,2213 (ж., 670,5 нм)[1] | ||
| Дипольный момент | 0,5337 Д | ||
| Рег. номер CAS | 10028-15-6 | ||
| PubChem | 24823 | ||
| Рег. номер EINECS | 233-069-2 | ||
| SMILES | [O-][O+]=O | ||
| InChI | 1S/O3/c1-3-2 CBENFWSGALASAD-UHFFFAOYSA-N | ||
| RTECS | RS8225000 | ||
| ChEBI | 25812 | ||
| ChemSpider | 23208 | ||
| ЛД50 | 4,8 ppm | ||
| Токсичность | сильнодействующий яд, обладающий раздражающим, канцерогенным и мутагенным действием | ||
| Пиктограммы СГС | |||
| NFPA 704 | 4 4 OX | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Строение озона[править | править код]
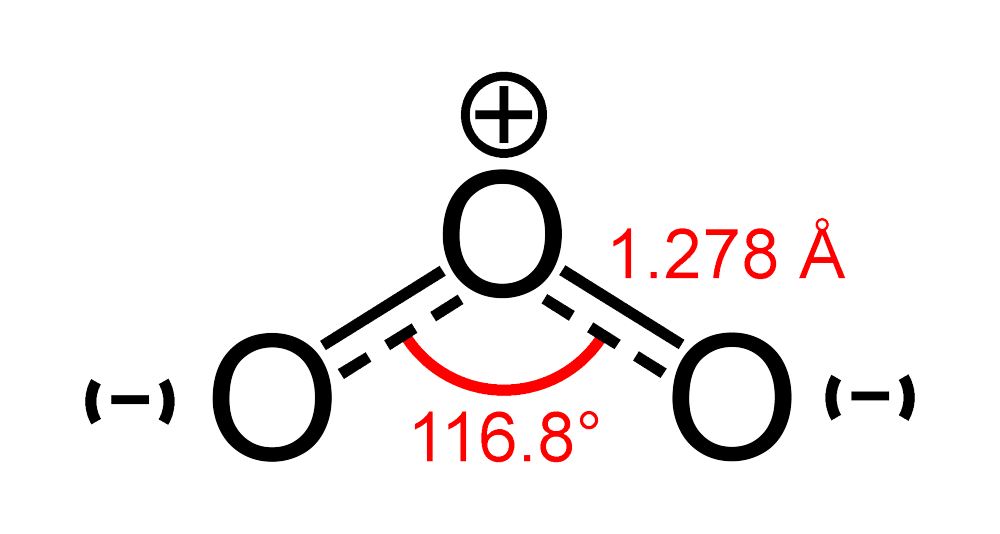
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°[4]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д[5].
История открытия[править | править код]
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[6]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[6]:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом[7].
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда[6].
Физические свойства[править | править код]
- Молекулярная масса — 48 а.е.м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658[8]).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³[1].
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3[1].
- Температура кипения −111,8(3) °C (161,3 К)[1]. Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению[9]. По другим сведениям[1]Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К)[1].
- Критическое давление 51,6 атм[1].
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с[1].
- Теплота плавления 2,1 кДж/моль[1].
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль[1]; при 90 К от 15,27 до 16,6 кДж/моль[1].
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы[1].
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ[1].
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Химические свойства[править | править код]
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[10] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины[11] и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония (англ.)русск. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего[12]:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[14]:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[12]:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину[15] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Получение озона[править | править код]
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[7]:
Токсичность[править | править код]
Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм является общетоксическим, раздражающим, канцерогенным и мутагенным, а также может приводить к преждевременной смерти[16].
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[17];
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[17];
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³.
- Минимальная смертельная концентрация (LC50) — 4,8 ppm
При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³[18].
Озон эффективно убивает плесень и бактерии.
Применение озона[править | править код]
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие[18] токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск его мутагенного, канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента[19].
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники[источник не указан 2978 дней].
Применение жидкого озона[править | править код]
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[20]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными[21]. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры и для повышения УИ осталось возможным перейти на новые виды топлива.
Озон в атмосфере[править | править код]
Распределение озона по высоте
Атмосферный (стратосферный) озон является продуктом воздействия солнечного излучения на атмосферный (О2) кислород. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждает растения.
Считается, что молнии Кататумбо являются крупнейшим одиночным генератором тропосферного озона на Земле.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Лунин, 1998.
- ↑ Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. ss. 91–100. Auflage. de Gruyter, 1985, S. 460.
- ↑ 1 2 https://www.cdc.gov/niosh/npg/npgd0476.html
- ↑ Takehiko Tanaka; Yonezo Morino. Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states // Journal of Molecular Spectroscopy. — 1970. — Vol. 33. — P. 538—551.
- ↑ Kenneth M. Mack; J. S. Muenter. Stark and Zeeman properties of ozone from molecular beam spectroscopy // Journal of Chemical Physics. — 1977. — Vol. 66. — P. 5278—5283.
- ↑ 1 2 3 С. С. Колотов, Д. И. Менделеев. Озон // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ 1 2 Получение озона и его определение — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑
Справочник химика, т. II. Л., «Химия», 1971. - ↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — М.: Химия, 1974.
- ↑ Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion? Архивировано 1 июня 2006 года.
- ↑ Платина не окисляется озоном, но катализирует его разложение.
- ↑ 1 2 Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 44-49
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 439.
- ↑ Housecroft & Sharpe, «Inorganic Chemistry». — 2005. — P. 265
- ↑ Horvath M., Bilitzky L., & Huttner J., 1985. «Ozone.» pg 259, 269—270
- ↑ National Academy of Sciences: Link Between Ozone Air Pollution and Premature Death Confirmed
- ↑ 1 2 Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест. Гигиенические нормативы 2.1.6.1338-03 (недоступная ссылка). Дата обращения 21 ноября 2012. Архивировано 3 декабря 2013 года.
- ↑ 1 2 Озон — мирное оружие XXI века — Костромской научно-исследовательский институт сельского хозяйства
- ↑ Questionable methods of cancer management: hydrogen peroxide and other ‘hyperoxygenation’ therapies Архивная копия от 7 июля 2010 на Wayback Machine, American Cancer Society
- ↑ Перспективные окислители. (недоступная ссылка). Дата обращения 24 декабря 2009. Архивировано 3 ноября 2009 года.
- ↑ The Dynamics of Unsteady Detonation in Ozone
Литература[править | править код]
- Разумовский С. Д., Заиков Г. Е. Озон и его реакции с органическими соединениями (кинетика и механизм). — М.: Наука, 1974. — 322 с.
- Лунин В. В., Попович М. П., Ткаченко С. Н. Физическая химия озона. — М.: МГУ, 1998. — 480 с. — ISBN 5-211-03719-7.
Ссылки[править | править код]
- [www.xumuk.ru/encyklopedia/2/3007.html Озон] — Химическая энциклопедия.
- Озон — не всегда хорошо // Наука и жизнь : журнал. — 1992. — № 8. — С. 155.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных доменов |
Начнем с самого простого вопроса: Откуда вообще берется озон и что это такое?
Для того, чтобы нам с вами жить, нужен кислород, то есть молекулы О2. Об этом все мы знаем еще со школы. Однако, кислород имеет аллотропную модификацию: О3, которую называют озоном.
В природе озон может образоваться несколькими способами. Первый – благодаря солнечной радиации. Второй – благодаря электрическим разрядам в атмосфере, то есть молниям.
Третий – в электромагнитных полях силовых кабелей и других электрических устройств.
Какое применение имеет озон?
Во-первых, озон является хорошим средством для обеззараживания питьевой воды, очистки промышленных сточных вод и выбросов в атмосферу от вредных примесей, например от фенолов и цианидов.
Во-вторых, в химии озон применяется как сильный окислитель.
Благодаря этому свойству озон используется для стерилизации изделий медицинского назначения; для отбеливания бумаги; для очистки масел.
Так что озон можно считать санитаром окружающей среды.
Также, тот факт, что озон более сильный окислитель, чем кислород нашел применение озону в качестве окислителя ракетного топлива. Только не в чистом виде, а в виде смеси кислород-озон.
В чистом виде жидкий озон не применяют, так как он химически неустойчив и взрывоопасен. Да к тому же озон еще и токсичен. На этом моменте плавно перейдем к отрицательным моментам, связанным с озоном.
Как выясняется, озон не во всех случаях полезен.
Конечно в XXI веке многие фирмы выпускают бытовые озонаторы для дезинфекции помещений, например для дома. Но почему-то они умалчивают о мерах безопасности.
Когда вы обеззараживаете помещение, используя такой прибор, не надо самому при этом присутствовать в помещении. Иначе вы рискуете медленно, но верно обеззаразить помещение и от себя, так как озон токсичен.
так выглядит озонатор воздуха
А потом кругом кричат, что экология у нас дрянь, сосед умер от рака, А ведь не пил, не курил, озонатором пользовался, за здоровьем следил.
Да, существуют озонотерапии в некоторых медицинских учреждениях. Но их эффективность клинически не доказана и в развитых странах озонотерапия не признаётся лекарственным методом.
Но если вы хотите дома убить плесень и бактерии, то озон к вашим услугам.
Что еще может сделать озон. Ну например…, хотя возле земли его мало, но его достаточно, чтобы разрушать резину, да хотя бы покрышек автомобилей или в рамах пластиковых окон. Резина трескается и постепенно разрушается.
На высоте 20-25 км над землей находится так называемый озоновый слой. В нем наибольшее содержание озона, где он образуется в результате воздействия ультрафиолетового излучения Солнца на молекулу кислорода.
Ультрафиолетовое излучение также действует на озон, разрушая его. При этом почти полностью поглощается жесткая часть ультрафиолета, которая вызывает загар и рак кожи, и до поверхности Земли доходит лишь несколько процентов.
Озоновый слой образовался в атмосфере Земли примерно 500—600 млн лет назад, когда в ней накопилось достаточно кислорода вследствие фотосинтеза. И только лишь после образования озонового слоя жизнь смогла выйти из океанов;
Без этого высокоразвитые формы жизни типа млекопитающих, включая человека, не возникли бы.
Теперь поговорим о химическом получении озона.
Для этого используем реакцию персульфата аммония с азотной кислотой:
3 (NH4)2S2O8 + 6 HNO3 + 3 H2O = 6 NH4NO3 + 6 H2SO4 + O3
Вот так выглядит устройство для проведения этой реакции. В колбе слева находится персульфат аммония с азотной кислотой
Осторожно подогреем смесь в колбочке и пропустим выходящий газ через раствор иодида калия. В результате образуется йод и раствор окрашивается в жёлтый цвет:
2 KI + O3 + H2O = 2 KOH + I2 + O2
В колбе справа жидкость потемнела и начал выделяться газ. Это и есть озон, а раствор потемнел из-за того, что выделился йод (о том, что такое йод можно прочитать в нашей статье)
Подводя итоги можно сказать о том, что озон является как помощником человека в некоторых делах и спасителем от солнечной радиации, так и сильным окислителем и ядовитым газом, который оказывает очень пагубное влияние.
На этом всё!
