Назовите какой продукт образуется при реакции h2so4
| Серная кислота | |||
|---|---|---|---|
| Систематическое наименование | серная кислота | ||
| Хим. формула | H2SO4 | ||
| Состояние | жидкость | ||
| Молярная масса | 98,078 ± 0,006 г/моль | ||
| Плотность | 1,8356 г/см³ | ||
| Динамическая вязкость | 21 мПа·с[1] | ||
| Температура | |||
| • плавления | 10,38 °C | ||
| • кипения | 337 °C | ||
| Удельная теплота плавления | 10,73 Дж/кг | ||
| Давление пара | 0,001 ± 0,001 мм рт.ст.[2] | ||
| Константа диссоциации кислоты | -3 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Показатель преломления | 1.397 | ||
| Дипольный момент | 2.72 Д | ||
| Рег. номер CAS | 7664-93-9 | ||
| PubChem | 1118 | ||
| Рег. номер EINECS | 231-639-5 | ||
| SMILES | OS(O)(=O)=O | ||
| InChI | 1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) QAOWNCQODCNURD-UHFFFAOYSA-N | ||
| Кодекс Алиментариус | E513 | ||
| RTECS | WS5600000 | ||
| ChEBI | 26836 | ||
| Номер ООН | 1830 | ||
| ChemSpider | 1086 | ||
| ЛД50 | 510 мг/кг | ||
| Пиктограммы СГС | |||
| NFPA 704 | 3 2 W | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с сильнокислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Название[править | править код]
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом»[3][4], очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Получение серной кислоты[править | править код]
Промышленный (контактный) способ[править | править код]
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
Нитрозный (башенный) способ[править | править код]
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Физические и физико-химические свойства[править | править код]
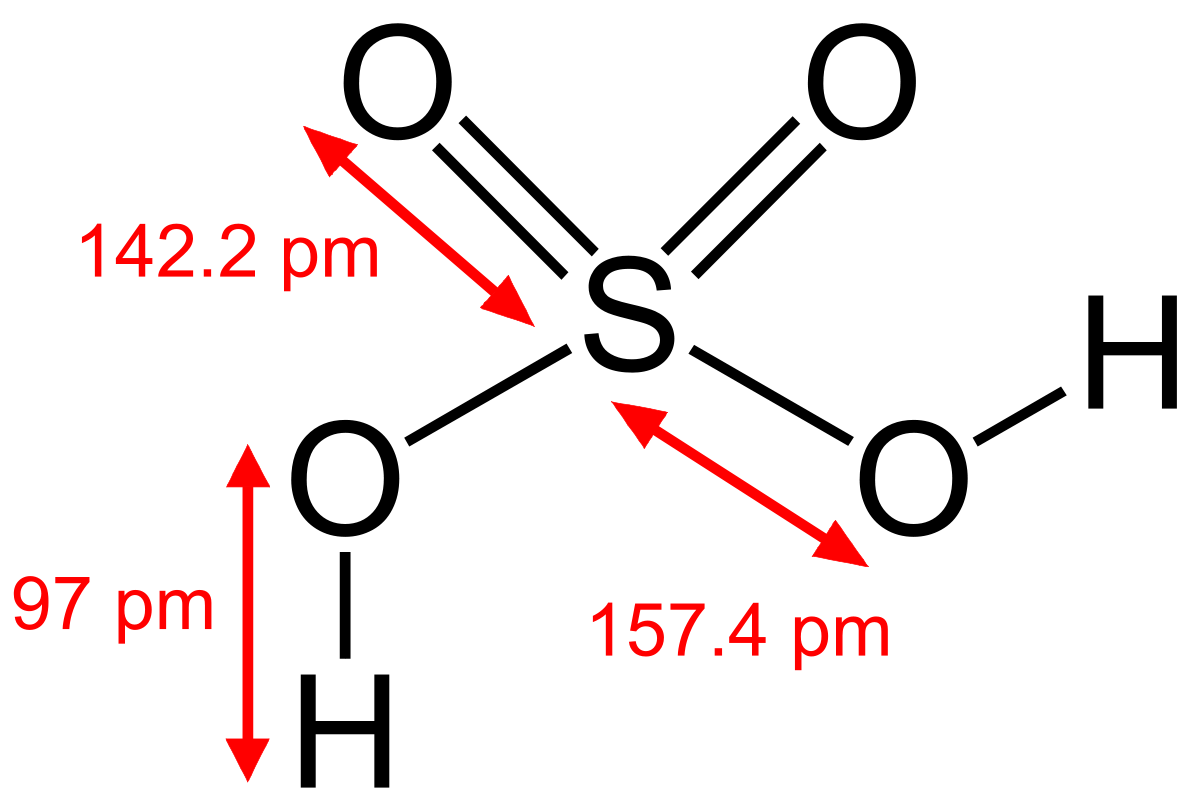
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3О+, HSO3+, и 2НSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум[править | править код]
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Сульфит
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4[источник не указан 3142 дня]. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства[править | править код]
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
Углерод до CO2, серу — до SO2.
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например[5]:
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ[5].
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например[5]:
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например[6]:
Применение[править | править код]
Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- для восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год[7]. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P₂O₅ фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH₄)₂SO₄ серной кислоты 75 % от массы расходуемого (NH₄)₂SO₄. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие[править | править код]
Серная кислота и олеум — очень едкие вещества. Они поражают все ткани организма. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Попадание кислоты на глаза может привести как к конъюнктивиту, так и к полной потере зрения.[8] Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
В РФ оборот серной кислоты концентрации 45 % и более — ограничен[9].
Исторические сведения[править | править код]
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси[10]
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV века в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешёвого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах.
Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.[11]
Дополнительные сведения[править | править код]
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[12]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994[13].
Стандарты[править | править код]
- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания[править | править код]
- ↑ Kirk-Othmer Encyclopedia of Chemical Technology — ISBN 0-471-23896-1
- ↑ https://www.cdc.gov/niosh/npg/npgd0577.html
- ↑ Ушакова Н. Н., Фигурновский Н. А. Василий Михайлович Севергин: (1765—1826) / Ред. И. И. Шафрановский. М.: Наука, 1981. C. 59.
- ↑ См. также Каменное масло
- ↑ 1 2 3 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 91. Химические свойства серной кислоты // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 209—211. — 240 с. — 1 630 000 экз.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Sulfuric acid (англ.) // «The Essential Chemical Industry — online»
- ↑ SULFURIC ACID | CAMEO Chemicals | NOAA. cameochemicals.noaa.gov. Дата обращения 22 мая 2020.
- ↑ Постановление Правительства Российской Федерации от 3 июня 2010 года № 398 (недоступная ссылка). Дата обращения 30 мая 2016. Архивировано 30 июня 2016 года.
- ↑ Эпштейн, 1979, с. 40.
- ↑ Эпштейн, 1979, с. 41.
- ↑ см. статью «Вулканы и климат» Архивная копия от 28 сентября 2007 на Wayback Machine (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? Архивная копия от 1 декабря 2007 на Wayback Machine (рус.)
Литература[править | править код]
- Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971
- Эпштейн Д. А. Общая химическая технология. — М.: Химия, 1979. — 312 с.
Ссылки[править | править код]
- Статья «Серная кислота» (Химическая энциклопедия)
- Плотность и значение pH серной кислоты при t=20 °C
== «В основе потенциометрического метода анализа лежит измерение:» Ответы на вопрос: 2. Приоритет 1. Текст: «электродных потенциалов» 18
Ответы на вопрос: 1. Приоритет 1. Текст: «коллоидными частицами» 2. Приоритет 1. Текст:»грубодисперсными»
== «Раствор какого электролита из ниже перечисленных при одинаковой моль эквивалентной концентрации наиболее эффективно вызовет коагуляцию отрицательно заряженного золя? Ответы на вопрос: 5. Приоритет 1. Текст: «AlCl3»
== «Какой знак заряда гранулы мицеллы золя СdS, полученного по реакции CdSO4 c Na2S при избытке первого?» Ответы на вопрос: 1. Приоритет 1. Текст: «положительный»
== «Соотнесите название дисперсной системы с агрегатным состоянием дисперсной фазы» Ответы на вопрос: 2. Текст: «топочный дым». Поставлен в соответствие с (1).»твердая» 3. Текст: «пена». Поставлен в соответствие с (1).»газообразная» 4. Текст: «мазут». Поставлен в соответствие с (1).»жидкая»
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Ag+»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Li»
== «Назовите какой продукт образуется при реакции H2SO4 конц с K, если реакция возможна.» Ответы на вопрос: 2. Приоритет 1. Текст: «H2S
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 2. Приоритет 1. Текст: «Zn»
== «Назовите какой продукт образуется при реакции H2SO4 конц. с Ca, если реакция возможна.» Ответы на вопрос: 1. Приоритет 1. Текст: «H2S
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?» Ответы на вопрос: 4. Приоритет 1. Текст: «Fe2+»
== «Какое вещество, выделяется на катоде при электролизе водного раствора MgCl2 Ответы на вопрос: 2. Приоритет 1. Текст: «H2»
== «Определите анодную реакцию в марганцево-магниевом гальваническом элементе.» Ответы на вопрос: 2. Приоритет 1. Текст: «Mg — 2e ? Mg2+»
== «Определите анодную реакцию в серебряно-цинковом гальваническом элементе.» Ответы на вопрос: 3. Приоритет 1. Текст: «Zn — 2e ? Zn2+»
== «Какое вещество, выделяется на аноде при электролизе водного раствора KCL» Ответы на вопрос: 4. Приоритет 1. Текст: «Cl2
== «Какое вещество, выделяется на аноде при электролизе водного раствора K2SO4» Ответы на вопрос: 2. Приоритет 1. Текст: «O2»
== «Определите катодную реакцию в железо-медном гальваническом элементе.» Ответы на вопрос: 3. Приоритет 1. Текст: «Cu2++2e ? Cu»
== «Какой из перечисленных металлов будет служить протектором для стальной конструкции. » Ответы на вопрос: 4. Приоритет 1. Текст: «никакой»
== «Какой из перечисленных металлов будет служить протектором для алюминиевого кабеля. «Ответы на вопрос: 2. Приоритет 1. Текст: «никакой»
== «Какой из перечисленных металлов будет служить протектором для медного кабеля.» Ответы на вопрос: 1. Приоритет 1. Текст: «Ni»
== «Возможна ли коррозия железной конструкции в воде, содержащей растворенный кислород? Если возможна, выберите уравнение анодного процесса Ответы на вопрос: 2. Приоритет 1. Текст: «Fe -2e ? Fe2+
== «Какой из перечисленных металлов будет служить протектором для медного кабеля. » Ответы на вопрос: 2. Приоритет 1. Текст: «Zn»
== «При взаимодейстии разбавленной серной кислоты с цинком выделяется водород.» Ответы на вопрос: 2. Приоритет 1. Текст: «да»
== «Люминесцентный анализ относится к методам:» Ответы на вопрос: 4. Приоритет 1. Текст: «спектральным»
== Потенциометрическим методом анализа определили потенциал водородного электрода?= -0,3в Определить PH этого раствора: образец ответа: 7 Ответы на вопрос: 1. Приоритет 1. Синонимы: «5»
== «Раствор соли Сu(II) при действии раствора аммиака NH3, приобрел цвет : Ответы на вопрос: 2. Приоритет 1. Текст: «ярко-синий»
== «К какому типу реакций, используемых при идентификации относится данная реакция: Cu(OH)2 + 2NaOH =Na2[Сu(OH)4] Ответы на вопрос: 3. Приоритет 1. Текст: «комплексообразования»
== «Методы анализа, основанные на измерении интенсивности светового потока, прошедшего через окрашенный раствор, относятся к …. » Ответы на вопрос: 2. Приоритет 1. Текст: «колориметрическим» == «В сточной воде предполагается присутствие ионов Fe2+. C помощью какого реактива можно их обнаружить: » Ответы на вопрос: Приоритет 1. Текст: «K3[Fe(CN)6]» 19
== «Ядро коллоидной частицы имеет заряд » Ответы на вопрос: 2. Приоритет 1. Текст: «нет»
== «Какие из перечисленных систем относятся к дисперсным системам: » Ответы на вопрос:
1. Приоритет 1. Текст: «порошок»
2. Приоритет 1. Текст: «нефть»
4. Приоритет 1. Текст: «мазут»
== «Дисперсная система состоит из жидкой дисперсионной среды и жидкой дисперсной фазы. Как можно назвать такую систему?» Ответы на вопрос: 3. Приоритет 1. Текст: «эмульсия»
== «Соотнесите название дисперсной системы с агрегатным состоянием дисперсной фазы » Ответы на вопрос: 1. Текст: «нефть». Поставлен в соответствие с (1).»жидкая» 2. Текст: «пенопласт». Поставлен в соответствие с (1).»газообразная» 5. Текст: «ситалл». Поставлен в соответствие с (1).»твердая»
== «Соотнесите название дисперсной системы с агрегатным состоянием дисперсной фазы » Ответы на вопрос: 3. Текст: «пенобетон». Поставлен в соответствие с (1).»газообразная» 4.
Текст: «кермет». Поставлен в соответствие с (1).»твердая» 5. Текст: «молоко». Поставлен в соответствие с (1).»жидкая»
== «Губка зто дисперсная система с твердой ДФ и жидкой ДС?» Ответы на вопрос: 1. Приоритет 1. Текст: «НЕТ»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Cа»
== «Назовите какой продукт образуется при реакции H2SO4 конц. с Ca, если реакция возможна.
Ответы на вопрос: 1. Приоритет 1. Текст: «H2S
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос: 2. Приоритет 1. Текст: «Ag+»
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Zn2+»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 4. Приоритет 1. Текст: «Al»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Fe» == «Определите катодную реакцию в серебряно-магниевом гальваническом элементе.» Ответы на вопрос: 3. Приоритет 1. Текст: «Ag+ + e ? Ag»
== «Какое вещество, выделяется на аноде при электролизе водного раствора KCl» Ответы на вопрос: 2. Приоритет 1. Текст: «Cl2
== «Определите анодную реакцию в медно-цинковом гальваническом элементе.» Ответы на вопрос: 2. Приоритет 1. Текст: «Zn — 2e ? Zn2+»
== «Какое вещество, выделяется на катоде при электролизе водного раствора Na2SO4» Ответы на вопрос:3. Приоритет 1. Текст: «H2»
== «Определите анодную реакцию в железо-медном гальваническом элементе. » Ответы на вопрос: 4. Приоритет 1. Текст: «Fe — 2e ? Fe2+»
== «Какое вещество, выделяется на катоде при электролизе водного раствора KJ » Ответы на вопрос: 4. Приоритет 1. Текст: «H2»
== «Какими из металлов было защищено от коррозии Sn, если на аноде протекает процесс: Zn — 2e ? Zn2+» Ответы на вопрос: 2. Приоритет 1. Текст: «Zn»
== «При электролизе водного раствора гидроксида калия на катоде выделяется: » Ответы на вопрос: 3. Приоритет 1. Текст: «водород»
== «Какими из металлов был защищен от коррозии Zn, если на аноде протекает процесс: Zn — 2e ? Zn2+» Ответы на вопрос: 3. Приоритет 1. Текст: «Ni» == «Железная пластинка покрыта серебром. Определить характер покрытия.» Ответы на вопрос: 2. Приоритет 1. Текст: «катодное»
== «При взаимодейстии концентрированной серной кислоты с металлами никогда не выделяется водород.» Ответы на вопрос: 1. Приоритет 1. Текст: «да» == «Покрытие железа хромом является анодным Ответы на вопрос: 1. Приоритет 1. Текст: «да
== «Какие из катионов при действии щелочи образуют осадок гидроксида, который растворяется в избытке щелочи : Ответы на вопрос:2. Приоритет 1. Текст: «Zn(II)» 4. Приоритет 1. Текст: «Al(III)» 5. Приоритет 1. Текст: «Cr(III)»
== «В расчетах при использовании потенциометрического метода анализа в уравнении: ?=?0(NO3)-/NH3 + 0,06/n * lgC величина «n» равна :образец ответа: 9 Ответы на вопрос: 1. Приоритет 1. Синонимы: «8»
== «К какому типу реакций, используемых при идентификации относится данная реакция: 2NaOH + Zn(OH)2 ? Na2[Zn(OH)4] Ответы на вопрос: 3. Приоритет 1. Текст: «комплексообразования»
== «Соотнесите :» Ответы на вопрос: 1. Текст: «титриметрический». Поставлен в соответствие с (1).»обьемный» 2. Текст: «гравиметрический». Поставлен в соответствие с (1).»весовой» == «В основе титриметрического метода анализа лежит закон:» Ответы на вопрос: 3. Приоритет 1. Текст: «эквивалентов»
== «Различная сорбционная способность определяемых веществ лежит в основе метода анализа: Ответы на вопрос: Приоритет 1. Текст: «хроматографического»0 == «Золь СdS по реакции между растворами K2S и Cd(NO3)2 при избытке первого. Какой из ионов будет потенциалопределяющим? » Ответы на вопрос:1. Приоритет 1. Текст: «S 2-2. Приоритет 0. Текст: «Cd 2+
== «Какие из перечисленных систем относятся к дисперсным системам:» Ответы на вопрос: 1. Приоритет 1. Текст: «молоко» 3. Приоритет 1. Текст: «порошок» 4. Приоритет 1. Текст: «паста»
== «Золь СdS по реакции между растворами K2S и Cd(NO3)2 при избытке последнего. Какой из ионов будет потенциалопределяющим?» Ответы на вопрос: 2. Приоритет 1. Текст: «Cd 2+ == «Какие из перечисленных систем относятся к дисперсным системам:» Ответы на вопрос: Приоритет 1. Текст: «порошок» 3. Приоритет 1. Текст: «почва » 4. Приоритет 1. Текст: «ситалл»
== «Губка зто дисперсная система с твердой ДФ и жидкой ДС?» Ответы на вопрос: Приоритет 1. Текст: «НЕТ»
«Дисперсная система состоит из твердой дисперсионной среды и твердой дисперсной фазы. Как можно назвать такую систему?» «твердая суспензия»
== «Назовите газообразный продукт, при реакции HNO3 конц. с Ag, если реакция возможна.» Ответы на вопрос: 1. Приоритет 1. Текст: «NO2
== «Назовите ион, который легче всего восстанавливается в стандартных условиях,используя значение ?0 Ответы на вопрос: 3. Приоритет 1. Текст: «Ag+»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 4. Приоритет 1. Текст: «Cа»
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос:2. Приоритет 1. Текст: «Zn2+»
«Назовите какой продукт образуется при реакции H2SO4 конц. с Cd, если реакция возможна.»»H2″
«Какое вещество, выделяется на аноде при электролизе водного раствора CaSO4»«O2»
«Какое вещество, выделяется на катоде при электролизе водного раствора NaJ«H2»
«Какое вещество, выделяется на аноде при электролизе водного раствора Na2SO4»«O2»
«Какое вещество, выделяется на аноде при электролизе водного раствора KJ«J2
«При электролизе расплава хлорида серебра на катоде выделяется:«серебро»
«При электролизе расплава хлорида алюминия на катоде выделяется:«алюминий»
«Какой из перечисленных металлов будет служить протектором для свинцового кабеля.»Ni»
«Потенциометрическим методом анализа определили потенциал водородного электрода. ?= -0,6 в Определить PH этого раствора:«10»
«В калориметрии измеряемой величиной является:«тепловой эффект реакции»
«В расчетах при использовании потенциометрического метода анализа в уравнении: ?=?0(NO3)-/NO + 0,06/n * lgC величина «n» равна«3»
«Инфракрасная спектроскопия используется для:«всего вышеперечисленного» «В кондуктометрическом методе анализа измеряемой величиной является: «электрическая проводимость»
«Расчеты результатов определений в титриметрии основаны на законе: эквивалентов»
«Cоотнесите: Термодинамическую характеристику реакции с возможностью самопроизвольного протекания реакцииG<0″. реакция возможна» 3. G=.0″в системе установилось равновесие» G>0″реакция невозможна»
«Cooтнесите вещества с с соответствующим типом химической связи:
«Ba». металлическая» «NСl».ионная» «HF». Ковалентная полярная»»Cl2″.ковалентная
неполярная»
«Cooтнесите вещества с соответствующим типомхимической связи: ««Br2 «.ковалентная неполярная» «Pb». металлическая»NH4Cl». ионная» «NH3». ковалентная
полярная»
«Определите значение константы равновесия системы: 3H2(г)+N2(г)?2NH3(г), если в реакционном
сосуде обьемом 1 литр содержится: 0,2 моля Н2, 0,2 моля N2, 2,2 моля NН33025
«Равновесие реакции: А+3В?2С установилось при следующих концентрациях реагирующих веществ, моль/л: *A+=3,5 *B+=2,8 *C+=4,6 Рассчитать константу равновесия этой реакции.«0,275»
«Как следует одновременно изменить температуру и давление в системе: 2CO(г)+O2(г)? 2СО2(г) ?H<0, чтобы сместить равновесие влево: ««повысить температуру» «понизить давление»
«Определить как изменится скорость прямой реакции: 2CO +O2 ? 2CO2, если общее давление в системе увеличится в 4 раза.«64»
«Для получения 22,4 л (н.у.) аммиака по реакции: N2(г)+3H2(г)?2NH3(г), ?H=-93,2 kDж требуется затратить теплоты: Размерность в kDж«93,2»
«Рассчитайте температуру, при которой ?G=0. 2SO2(г)+O2?2SO3(г)«1053»
«Вычислить, во сколько раз возрастает скорость реакции при увеличении температуры на 400 С, если температурный коэффициент реакции равен 3.«81 раз»
«Во сколько раз возрастает скорость химической реакции при повышении температуры на 500С. Температурный коэффициент равен 2. «32»
«Изотопы атомов одного элемента отличаются по числу :»«числу нейтронов «
«Сравнить массы,в граммах 1 моль NH3(х)и 1 моль NO2(y)»x<y»
«Верно ли утверждение:1 моль молекул водорода содержит 6,02 ? 1023 молекул«нет»
«Для вычисления мольной массы МЭ эквивалента H3PO4 в реакции образования соли Na3PO4 используется соотношение:«МЭ=М/3»
«Для вычисления мольной массы эквивалента (MЭ) элемента N в соединении N2O5используетсясоотношение:«МЭ=А/5»
«Для вычисления мольной массы эквивалента H3PO4 (МЭ) в реакции образования соли NaH2PO4 используется соотношение:«МЭ=М/1»
«Для вычисления мольноймассы эквивалента (MЭ)Mg(OH)2 в реакции образования соли MgOHClиспользуется соотношение:«МЭ=М/1»
«Определить количество моль H2SO4, содержащих 3,01?1024 молекул.»5″
«Определить количество моль Са в 100 граммах.»2,5″
«Определить количествомоль Fe, содержащих 6,02?1024 молекул.»10″
«Определить количество моль NН3 в 68 граммах.«4»
«На основании закона эквивалентов определить, какое из соотношений необходимо использовать для расчета массы(М) (в граммах) содержащегося в сточной воде токсичного иона Pb2+, если для его осаждения использовали 500 граммов щелочи NaOH«МPb2+/103,5=500/40»
Date: 2016-11-17; view: 743; Нарушение авторских прав
