Что такое агрегатные состояния какими свойствами они обладают
Агрега́тное состоя́ние вещества (от лат. aggrego «присоединяю») — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления.
Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин.[1]
Традиционно выделяют три агрегатных состояния: твёрдое, жидкое и газообразное. К агрегатным состояниям принято причислять также плазму[2], в которую переходят газы при повышении температуры и фиксированном давлении. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Существуют и другие агрегатные состояния.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Основным термодинамическим (феноменологическим) признаком различия видов агрегатного состояния вещества является наличие энергетической границы между фазами: теплота испарения как граница между жидкостью и её паром и теплота плавления как граница между твёрдым веществом и жидкостью[3].
Четыре основных состояния[править | править код]
Твёрдое тело[править | править код]
Кристаллические вещества: атомное разрешение изображения титаната стронция. Яркие атомы — Sr, темнее их Ti.
В твёрдом состоянии вещество сохраняет как форму, так и объём. При низких температурах все вещества замерзают — превращаются в твёрдые тела. Температура затвердевания может быть несколько повышена при увеличении давления. Твёрдые тела делятся на кристаллические и аморфные. С микроскопической точки зрения твёрдые тела характерны тем, что молекулы или атомы в них в течение длительного времени сохраняют своё среднее положение неизменным, только совершая колебания с небольшой амплитудой вокруг них. В кристаллах средние положения атомов или молекул строго упорядочены. Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки. Естественная форма кристаллов — правильные многогранники.
В аморфных телах атомы колеблются вокруг хаотически расположенных точек, у них отсутствует дальний порядок, но сохраняется ближний, при котором молекулы расположены согласованно на расстоянии, сравнимом с их размерами. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Частным случаем аморфного состояния является стеклообразное состояние. Аморфное тело находится в метастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется. Аморфное тело можно рассматривать как жидкость с очень большой (часто бесконечно большой) вязкостью. Кристаллические твёрдые тела имеют анизотропные свойства, то есть их отклик на приложенные внешние силы зависит от ориентации сил относительно кристаллографических осей. В твердотельном состоянии вещества могут иметь много фаз, которые отличаются составлением атомов или другими характеристиками, такими как упорядочение спинов в ферромагнетиках.
Жидкость[править | править код]
Структура классической одноатомной жидкости.
В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это означает, что жидкость может занимать только часть объёма сосуда, но также может свободно перетекать по всей поверхности сосуда. Жидкое состояние обычно считают промежуточным между твёрдым телом и газом.
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает изменение формы (внутренних частей жидкого тела).
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твёрдое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления.
Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения — это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза).
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей.
Как и газ, жидкости тоже в основном изотропные. Однако, существуют жидкости с анизотропными свойствами — жидкие кристаллы. Кроме изотропной, так называемой нормальной фазы, эти вещества, мезогены, имеют одну или несколько упорядоченных термодинамических фаз, которые называют мезофазы. Составление в мезофазы происходит благодаря особой форме молекул жидких кристаллов. Обычно это длинные узкие молекулы, которым выгодно укладываться так, чтобы их оси совпадали.
Газ[править | править код]
Основная статья: Газ
Промежутки между молекулами газа очень большие. Молекулы газа обладают очень слабыми связями. Молекулы в газе могут перемещаться свободно и быстро.
Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Причем заполняет весь доступный ему объём. Это состояние, свойственное веществам с малой плотностью. Переход из жидкого в газообразное состояние называют испарением, а противоположный ему переход из газообразного состояния в жидкое — конденсацией. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой. С микроскопической точки зрения газ — это состояние вещества, в котором его отдельные молекулы взаимодействуют слабо и движутся хаотически. Взаимодействие между ними сводится к спорадическим столкновениям. Кинетическая энергия молекул превышает потенциальную. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). По химическим свойствам газы и их смеси весьма разнообразны — от малоактивных инертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других частиц — фотонов, электронов, броуновских частиц, а также плазму. Некоторые вещества не имеют газообразного состояния. Это вещества со сложным химическим строением, которые при повышении температуры распадаются вследствие химических реакций раньше, чем становятся газом. Не существует различных газообразных термодинамических фаз одного вещества. Газам свойственна изотропия, то есть независимость характеристик от направления. В привычных для человека земных условиях, газ имеет одинаковую плотность в любой точке, однако это не является универсальным законом, во внешних полях, например в поле тяготения Земли, или в условиях различных температур плотность газа может меняться от точки к точке. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
Плазма[править | править код]
Плазменная декоративная лампа.
Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или полностью ионизированным газом и в равновесном состоянии обычно возникает при высокой температуре, от нескольких тысяч К[1] и выше. В земных условиях плазма образуется в газовых разрядах. Её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика, то есть равноправной с ионами и электронами составляющей плазмы является электромагнитное поле.
Плазма — самое распространённое во Вселенной агрегатное состояние вещества. В этом состоянии находится вещество звёзд и вещество, наполняющее межпланетное, межзвёздное и межгалактическое пространство. Бо́льшая часть барионного вещества (по массе около 99,9 %) во Вселенной находится в состоянии плазмы.[4].
Фазовый переход[править | править код]
Фазовый переход по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и тому подобное) происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться).
Низкотемпературные состояния[править | править код]
Сверхтекучесть[править | править код]
Способность вещества в особом состоянии (квантовой жидкости), возникающем при понижении температуры к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разреженных атомных бозе-конденсатах, твёрдом гелии.
Сверхтекучесть объясняется следующим образом. Поскольку атомы гелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии. Поскольку энергия состояний дискретна, атом может получить не любую энергию, а только такую, которая равна энергетическому зазору между соседними уровнями энергии. Но при низкой температуре энергия столкновений может оказаться меньше этой величины, в результате чего рассеяния энергии попросту не будет происходить. Жидкость будет течь без трения.
Конденсат Бозе — Эйнштейна[править | править код]
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фешбаха[en].
Фермионный конденсат[править | править код]
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов.
(В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше.
[5]
Вырожденный газ[править | править код]
Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц. Вырождение наступает в условиях, когда расстояния между частицами газа становятся соизмеримыми с длиной волны де Бройля; в зависимости от спина частиц выделяются два типа вырожденных газов — ферми-газ, образованный фермионами (частицами с полуцелым спином) и бозе-газ, образованный бозонами (частицами с целым спином).
Сверхтекучее твёрдое тело[править | править код]
Термодинамическая фаза квантовой жидкости, представляющей собой твёрдое тело со свойствами сверхтекучей жидкости.
Высокоэнергетические состояния[править | править код]
Глазма[править | править код]
Состояние адронного поля[6], предшествующее при столкновениях кварк-глюонной плазме. Состоит из цветных токовых трубок.[7] Глазма является особенностью теоретической модели «конденсата цветового стекла» (англ. color glass condensate) — подхода к описанию сильного взаимодействия в условиях высоких плотностей[8].
Глазма образуется при столкновении адронов друг с другом (например, протонов с протонами, ионов с ионами, ионов с протонами). Считается также, что в эволюции Вселенной состояние глазмы предшествовало кварк-глюонной плазме, которая существовала в первые миллионные доли секунды сразу после Большого взрыва. Время существования глазмы — несколько иоктосекунд[9].
Кварк-глюонная плазма[править | править код]
Состояние вещества в физике высоких энергий и физике элементарных частиц, при котором адронное вещество переходит в состояние, аналогичное состоянию, в котором находятся электроны и ионы в обычной плазме. Ему предшествует состояние глазмы[10] (глазма термализуется, то есть разрушается, порождая множество хаотично движущихся кварков, антикварков и глюонов: кварк-глюонную плазму[11]).
Состояния при большом давлении[править | править код]
Нейтронное состояние[править | править код]
Принципиально отличное от других состояние вещества, состоящее только из нейтронов. В нейтронное состояние вещество переходит при сверхвысоком давлении, недоступном пока в лаборатории, но которое существует внутри нейтронных звезд. При переходе в нейтронное состояние, электроны вещества объединяются с протонами и превращаются в нейтроны. Для этого необходимо, чтобы силы гравитации сжали вещество настолько, чтобы преодолеть отталкивание электронов, обусловленное принципом Паули. В результате в нейтронном состоянии вещество полностью состоит из нейтронов и имеет плотность порядка ядерной. Температура вещества при этом не должна быть очень высокой (в энергетическом эквиваленте, в пределах от сотни МэВ).
Другие состояния[править | править код]
Тёмная материя[править | править код]
Форма материи, которая не испускает электромагнитного излучения и не взаимодействует с ним. Это свойство данной формы вещества делает невозможным её прямое наблюдение. Однако возможно обнаружить присутствие тёмной материи по создаваемым ею гравитационным эффектам.
Обнаружение природы тёмной материи поможет решить проблему скрытой массы, которая, в частности, заключается в аномально высокой скорости вращения внешних областей галактик.
Сверхкритический флюид[править | править код]
Состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также исчезает. Коэффициент диффузии при этом имеет промежуточное между жидкостью и газом значение. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определёнными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода.
Вырожденная материя[править | править код]
- Ферми-газ — 1-я стадия: электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия — нейтронное состояние: в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом должна быть ниже триллиона градусов (в энергетическом эквиваленте не более сотни МэВ).
- При повышении температуры выше сотни МэВ в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно[12], деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно.
См. также[править | править код]
- Тройная точка
- Нормальные и стандартные условия
Примечания[править | править код]
Литература[править | править код]
- Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. — Л.: Наука, 1988. — ISBN 5-02-024564-X.
Определение 1
Агрегатные состояния вещества(от лат. “aggrego” означает “присоединяю”, “связываю”) – это состояния одного и того же вещества в твердом, жидком и газообразном виде.
При переходе из одного состояния в другое наблюдается скачкообразное изменение энергии, энтропии, плотности и прочих свойств вещества.
Твердые и жидкие тела
Определение 2
Твердые тела – это тела, которые отличаются постоянством своей формы и объема.
В твердых телах межмолекулярные расстояния маленькие, а потенциальную энергию молекул можно сравнить с кинетической.
Твёрдые тела подразделяются на 2 вида:
- Кристаллические;
- Аморфные.
В состоянии термодинамического равновесия находятся только лишь кристаллические тела. Аморфные же тела по факту представляют собой метастабильные состояния, которые по строению схожи с неравновесными, медленно кристаллизующимися жидкостями. В аморфном теле происходит чересчур медленный процесс кристаллизации, процесс постепенного преобразования вещества в кристаллическую фазу. Разница кристалла от аморфного твердого тела состоит, в первую очередь, в анизотропии его свойств. Свойства кристаллического тела определяются в зависимости от направления в пространстве. Разнообразные процессы (например, теплопроводность, электропроводность, свет, звук) распространяются в разных направлениях твердого тела по-разному. А вот аморфные тела (например, стекло, смолы, пластмассы) изотропные, как и жидкости. Разница аморфных тел от жидкостей заключается лишь только в том, что последние текучие, в них не происходят статические деформации сдвига.
У кристаллических тел правильное молекулярное строение. Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Определение 3
Жидкие тела – это тела, имеющие определенный объем, но не имеющие упругой формы.
Для вещества в жидком состоянии характерно сильное межмолекулярное взаимодействие и малая сжимаемость. Жидкость занимает промежуточное положение между твердым телом и газом. Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Газ, испарение, конденсация и плавление
Определение 4
Газ – это такое состояние вещества, при котором расстояния между молекулами огромны.
Силами взаимодействия между молекулами при небольших давлениях можно пренебречь. Частицы газа заполоняют весь объем, который предоставлен для газа. Газы рассматривают как сильно перегретые либо ненасыщенные пары. Особый вид газа – плазма (частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов почти одинаковые). То есть плазма – это газ из заряженных частиц, взаимодействующих между собой при помощи электрических сил на большом расстоянии, но не имеющих ближнего и дальнего расположения частиц.
Как известно, вещества способны переходить из одного агрегатного состояния в другое.
Определение 5
Испарение – это процесс изменения агрегатного состояния вещества, при котором с поверхности жидкости либо твердого тела вылетают молекулы, кинетическая энергия которых преобразовывает потенциальную энергию взаимодействия молекул.
Испарение является фазовым переходом. При испарении часть жидкости или твердого тела преобразуется в пар.
Определение 6
Вещество в газообразном состоянии, которое находится в динамическом равновесии с жидкостью, называется насыщенным паром. При этом изменение внутренней энергии тела равняется:
∆U=±mr (1),
где m – это масса тела, r – это удельная теплота парообразования (Дж/кг).
Определение 7
Конденсация представляет собой процесс, обратный парообразованию.
Изменение внутренней энергии рассчитывается по формуле (1).
Определение 8
Плавление – это процесс преобразования вещества из твердого состояния в жидкое, процесс изменения агрегатного состояния вещества.
При нагревании вещества растет его внутренняя энергия, поэтому увеличивается скорость теплового движения молекул. При достижении веществом своей температуры плавления кристаллическая решетка твердого тела разрушается. Связи между частицами также разрушаются, растет энергия взаимодействия между частицами. Теплота, которая передается телу, идет на увеличение внутренней энергии данного тела, и часть энергии расходуется на совершение работы по изменению объема тела при его плавлении. У многих кристаллических тел объем увеличивается при плавлении, однако есть исключения (к примеру, лед, чугун). Аморфные тела не обладают определенной температурой плавления. Плавление представляет собой фазовый переход, который характеризуется скачкообразным изменением теплоемкости при температуре плавления. Температура плавления зависит от вещества и она остается неизменной в ходе процесса. Тогда изменение внутренней энергии тела равняется:
∆U=±mλ (2),
где λ – это удельная теплота плавления (Дж/кг).
Определение 9
Кристаллизация представляет собой процесс, обратный плавлению.
Изменение внутренней энергии рассчитывается по формуле (2).
Изменение внутренней энергии каждого тела системы при нагревании или охлаждении вычисляется по формуле:
∆U=mc∆T (3),
где c – это удельная теплоемкость вещества, ДжкгК, △T – это изменение температуры тела.
Определение 10
При рассматривании преобразований веществ из одних агрегатных состояний в другие нельзя обойтись без так называемого уравнения теплового баланса: суммарное количество теплоты, выделяемое в теплоизолированной системе, равняется количеству теплоты (суммарному), которое в данной системе поглощается.
Q1+Q2+Q3+…+Qn=Q’1+Q’2+Q’3+…+Q’k.
По сути, уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
Пример 1
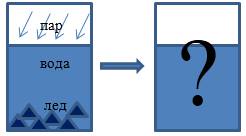
В теплоизолированном сосуде находятся вода и лед с температурой ti=0°C. Масса воды mυ и льда mi соответственно равняется 0,5 кг и 60 г. В воду впускают водяной пар массой mp=10 г при температуре tp=100°C. Какой будет температура воды в сосуде после того, как установится тепловое равновесие? При этом теплоемкость сосуда учитывать не нужно.

Рисунок 1
Решение
Определим, какие процессы осуществляются в системе, какие агрегатные состояния вещества мы наблюдали и какие получили.
Водяной пар конденсируется, отдавая при этом тепло.
Тепловая энергия идет на плавление льда и, может быть, нагревание имеющейся и полученной изо льда воды.
Прежде всего, проверим, сколько теплоты выделяется при конденсации имеющейся массы пара:
Qp=-rmp;Qp=2,26·106·10-2=2,26·104 (Дж),
здесь из справочных материалов у нас есть r=2,26·106 Джкг – удельная теплота парообразования (применяется и для конденсации).
Для плавления льда понадобится следующее количество тепла:
Qi=λmiQi=6·10-2·3,3·105≈2·104 (Дж),
здесь из справочных материалов у нас есть λ=3,3·105 Джкг – удельная теплота плавления льда.
Выходит, что пар отдает тепла больше, чем необходимо, только для расплавления имеющегося льда, значит, уравнение теплового баланса запишем следующим образом:
rmp+cmp(Tp-T)=λmi+c(mυ+mi)(T-Ti).
Теплота выделяется при конденсации пара массой mp и остывании воды, образуемой из пара от температуры Tp до искомой T. Теплота поглощается при плавлении льда массой mi и нагревании воды массой mυ+mi от температуры Ti до T. Обозначим T-Ti=∆T для разности Tp-T получаем:
Tp-T=Tp-Ti-∆T=100-∆T.
Уравнение теплового баланса будет иметь вид:
rmp+cmp(100-∆T)=λmi+c(mυ+mi)∆T;c(mυ+mi+mp)∆T=rmp+cmp100-λmi;∆T=rmp+cmp100-λmicmυ+mi+mp.
Сделаем вычисления с учетом того, что теплоемкость воды табличная
c=4,2·103 ДжкгК, Tp=tp+273=373 К, Ti=ti+273=273 К:∆T=2,26·106·10-2+4,2·103·10-2·102-6·10-2·3,3·1054,2·103·5,7·10-1≈3 (К),
тогда T=273+3=276 К
Ответ: Температура воды в сосуде после установления теплового равновесия будет равняться 276 К.
Пример 2
На рисунке 2 изображен участок изотермы, который отвечает переходу вещества из кристаллического в жидкое состояние. Что соответствует данному участку на диаграмме p,T?
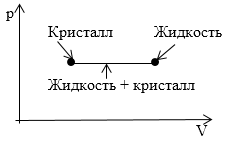
Рисунок 2
Ответ: Вся совокупность состояний, которые изображены на диаграмме p,V горизонтальным отрезком прямой на диаграмме p,T показано одной точкой, которая определяет значения p и T, при которых происходит преобразование из одного агрегатного состояния в другое.
